文|动脉网
就在月初,再生元在美国起诉诺华,称其通过欺诈手段获得专利,并利用专利阻止再生元进入预填充注射器市场。
再生元认为早在2005年,它与提供药物灌装服务的公司Vetter签订合同,为其与拜耳合作研发的抗VEGF产品阿柏西普(EYLEA)开发预充式注射器,并拥有相关专利的所有权。而Vetter之后与诺华达成协议,开发雷珠单抗(Lucentis)的预充式注射器侵犯了该项专利。
官司的背后反映出两大抗VEGF药物阿柏西普(Eylea)和雷珠单抗(Lucentis)之间激烈的竞争。两款药物多年来一直在眼科领域中互争高低。这次专利官司的胜负,或将左右两款药物的市场走势。
国内市场,抗VEGF药物过去呈现出诺华(雷珠单抗)、拜耳(阿柏西普)和康弘(康柏西普)三足鼎立的局面,可随着罗氏和齐鲁制药的加入,多年来波澜不惊的眼底治疗领域,将进入五家混战的乱局。其中的重头戏,或将出现罗氏、康弘和齐鲁,三英战诺华的场面。VEGF药物市场混战,一触即发。
为什么诺华成为标靶?

眼科领域竞争越来越激烈时,诺华却开始剥离眼科资产。
2023年6月底,诺华宣布与博士伦达成一项协议,将部分眼科资产以25亿美元出售给对方,其中包括17.5亿美元的预付现金,以及额外的里程碑付款。
这笔交易包括首个获批用于治疗干眼病体征和症状的处方药物Xiidra,正在开发的用于治疗慢性眼表疼痛(COSP)的研究药物SAF312(libvatrep),在干眼适应症使用AcuStream给药装置的权利,以及处于临床前开发阶段的第二代TRPV1拮抗剂OJL332。
此前,诺华还剥离了爱尔康并且将五款已获美国FDA批准的眼科产品在美国的独家商业化权利转让给了眼部护理制药公司Harrow Health。
从年报数据来看,诺华2023年全年营收454.40亿美元,同比增长10%;净利润85.72亿美元,同比上涨62%。其中,治疗心衰的Entresto销售收入60.35亿美元,同比增长31%。而昔日的明星产品雷珠单抗(Lucentis)销售仅15亿美元,同比下降20%,在专利到期后,已经连续3年下滑。
之前,诺华希望AAV基因疗法GT005可以接班,但由于研发不顺该管线已于去年9月宣布停止开发。被寄予厚望的新一代抑制VEGF的眼底血管病变治疗药物布西珠单抗(brolucizumab),尽管此前已获FDA批准用于湿性年龄相关性黄斑变性和糖尿病性黄斑水肿,但市场反应不容乐观。
诺华原本希望布西珠单抗可用于雷珠单抗的补充升级治疗,但上市后有部分患者有视网膜血管炎的不良反应,严重者甚至会视力丧失,因而引发争议。该药在2023年全球范围内销售额仅2亿美元,上市两年后市场份额也未见起色。布西珠单抗注射液国内的上市申请虽然已获CDE受理,可即使未来获批,也很难代替雷珠单抗提供高额营收。
之前,国内上市的眼科VEGF药物有三款,分别为雷珠单抗、阿柏西普和康柏西普,前两者的专利保护期已过,后者的专利从2025年开始陆续到期。为此,拜耳希望通过加大剂量来提高临床疗效,其8mg阿柏西普高剂量制剂已获FDA批准。而康弘药业则希望通过基因疗法来解决问题,KH631作为康弘药业研制用于治疗AMD的新一代眼科基因治疗产品,有望实现“一次治疗,终生治愈”的潜在疗效。
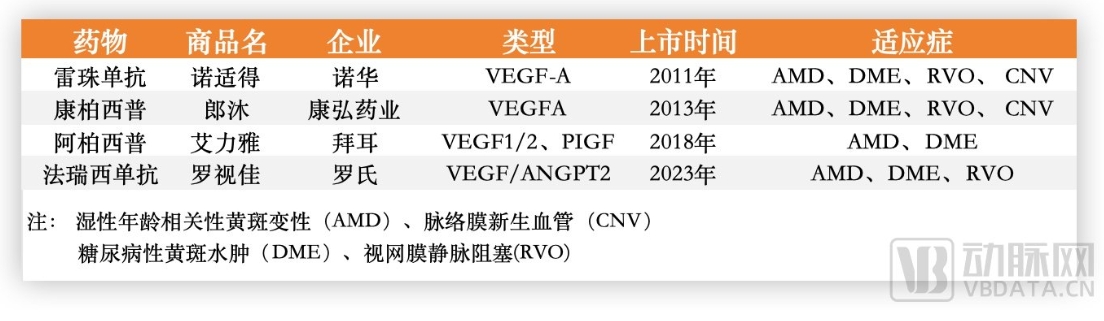
国内获批的四款抗VEGF药物,数据源于公开信息
反观诺华,后续可出的牌并不多,如果说雷珠单抗凭借先发优势占据了不少市场份额,可近几年阿柏西普的增速已经反超,再加上第四款药物罗氏法瑞西单抗以及齐鲁制药的阿柏西普生物类似药的获批,自身在眼科领域研发进展缓慢的诺华自然成为罗氏、齐鲁和康弘围追堵截的目标。
不仅是国内市场,齐鲁的另一款生物类似药雷珠单抗接连在欧盟和英国获批上市,成为首个出海成功的眼科生物类似药。也就是说,无论是国内还是海外,诺华在眼科领域面临的竞争已愈加激烈。
爆款新品获批,趁你弱要你命
随着2023年底,罗氏的法瑞西单抗获得国家药品监督管理局正式批准上市,罗氏中国再迎重磅产品。
此次获批的法瑞西单抗是全球首个针对眼部设计的双特异性抗体,被誉为眼科领域十多年以来首个具有新型作用机制的新疗法。法瑞西单抗于2022年1月在美国获批,也是FDA批准的首款眼科双抗药物。之后在日本、英国和加拿大等多个国家和地区获批上市,仅两年时间就累计注射超过200万针,2023年全球销售额超26亿美元,同比增长324%。
销量剧增的原因在于其独特的创新机制。法瑞西单抗作为一款双特异性抗体可以作用在引起多种视网膜疾病的血管内皮生长因子A(VEGF-A)和血管生成素2(ANG-2)两条通路。法瑞西单抗通过阻断VEGF-A的信号通路来有效控制新生血管的形成,同时还能抑制ANG-2信号来改善血管稳定性和减轻视网膜炎症。
此外,给药机制上的改进,也让法瑞西单抗的竞争力进一步提高。之前,同类药物的用药频率维持在约3个月一次,而法瑞西单抗注的射频率降低至4个月一次,既提升了患者的依从性也降低了使用成本。
法瑞西单抗除了在2023年底获批的糖尿病黄斑水肿(DME)适应症之外,在2024年1月,国家药监局又批准其用于治疗新生血管性年龄相关性黄斑变性(AMD)。
在眼科领域,罗氏采取了重点领域集中部署重磅产品的策略,主要聚焦于糖尿病性黄斑水肿(DME)、年龄相关性黄斑变性(AMD)、地图状萎缩(GA)、视网膜静脉阻塞糖尿病性视网膜病变(RVO)等适应症上。除了法瑞西单抗外,罗氏在眼科领域还有10多个新分子实体或适应症的开发正在有序推进中。
可以看到,罗氏在其“老三样”贝伐珠单抗、曲妥珠单抗与利妥昔单抗销售下滑的情况下,凭借之前的前瞻布局,迅速拿出了“新三板斧”实体瘤PD-L1泰圣奇、多发性硬化症 (MS) 药物Ocrevus以及法瑞西单抗来扛起销售大旗。
当然,罗氏的销售策略也在其中起到重要作用。以欧洲市场为例,罗氏将法瑞西单抗在德国的售价定在1100欧元左右,比美国市场低约40%,上市第二年全球销售额便已超过雷珠单抗。2023年,罗氏在国内的销售额增长了6%,如果罗氏在国内市场继续采取这样激进的销售策略,无疑将会冲击VEGF药物市场现有的格局。
这样一个对手携重磅产品加入国内眼科战局,对任何企业来说都是一件头疼的事情。
本土药企加入战团
除了罗氏这个老对手,诺华在国内市场还要面对本土药企的竞争。
就4月17日,装载着中国首个出口的眼科生物制剂、山东首个出口的生物单抗类似药雷珠单抗注射液的冷链货车,从齐鲁制药生物医药产业园驶出。这批雷珠单抗制剂将通过航空控温集装箱实现对欧的出口运输。
今年1月,齐鲁制药研发的雷珠单抗注射液获得欧洲药品管理局(EMA)上市批准,成为首个出海成功的眼科生物类似药。仅仅半个月后 ,齐鲁制药便收到来自欧盟国家的订单。2月,雷珠单抗注射液又在英国获批。再加上阿柏西普生物类似药在国内的获批,齐鲁制药开始参与VEGF药物的竞争。
做出阿柏西普生物类似药并不是多么让人惊奇的事情,但如果做出这件事的企业是齐鲁制药,那后续发展就引人遐想了。
成立四十多年来,齐鲁制药从名不见经传的小厂到中国医药工业百强第五,再到成为同时向欧、美、英、日、澳大利亚法规市场出口制剂的药企。令人称道的不仅是其扎实的制药能力,还有超强的销售能力。
2019年底,齐鲁制药成功推出国内首款生物类似药贝伐珠单抗。在此之前,罗氏原研的贝伐珠单抗安维汀在中国营销推广了数年,销售额接近30亿元。可就在齐鲁入局的两年后,据中康开思的数据,2022年,齐鲁制药以54%的市场份额反超了原研的罗氏。齐鲁的销售能力可见一斑。
据米内网数据,阿柏西普被纳入医保后销售额立即破亿,在2020年~2022年的增速分别为106.52%、59.40%和18.69%。到了2023年,阿柏西普在国内已跻身为眼科用药前三,约占眼底用药的25%左右,增速高于雷珠单抗和康柏西普。
再加上齐鲁制药的雷珠单抗类似药在欧洲获批,其在国内获批时间也将临近。届时,销售能力超强的齐鲁制药携两大杀器,又将在国内VEGF药物市场掀起一片波澜。
还有诺华的老对手康弘药业,其核心产品康柏西普,当年在国内上市时不仅填补了国产湿性眼底黄斑变性药品的市场空白,一举打破了诺华在国内市场的垄断地位。2017年,康柏西普和雷珠单抗都纳入医保后,雷珠单抗于2018年销售超10亿,可在2020年和2021年,康柏西普销售业绩成功反超。此外,拜耳的阿柏西普也在2019年进入医保,他们之间的竞争同样不会停歇。
据《中华眼底杂志》2023年的研究数据,我国70岁以上人群AMD的患病率为20.2%,随着我国人口老龄化的加剧,年龄相关性黄斑变性(AMD)的患者数量也在持续上升。因此未来眼科药物市场成为多家药企重点关注领域。
三家跨国药企在再加上两家国内药企,国内VEGF领域的混战一触即发,如果说之前康弘药业一家国内企业还孤掌难鸣,随着齐鲁制药的上桌,市场竞争必然升级。康弘、齐鲁和罗氏,三英战诺华的局面即将形成,仅仅依靠雷珠单抗的诺华能抵抗多久?让我们拭目以待。
混战还将持续
即使眼前的混战在短期内有了结果,也不意味着胜利者能就此高枕无忧,因为还有更多的参与者等着上桌。
罗氏法瑞西单抗的成功像黑暗中的明灯,指引着抗VEFG眼科药物沿着双抗,甚至是三抗的方向发展,并呈现出百花齐放的态势,这其中中国药企参与颇深。在国内VEGF单抗研发中,兆科眼科、迈威生物、泰康生物、百奥泰等已处于临床3期阶段。
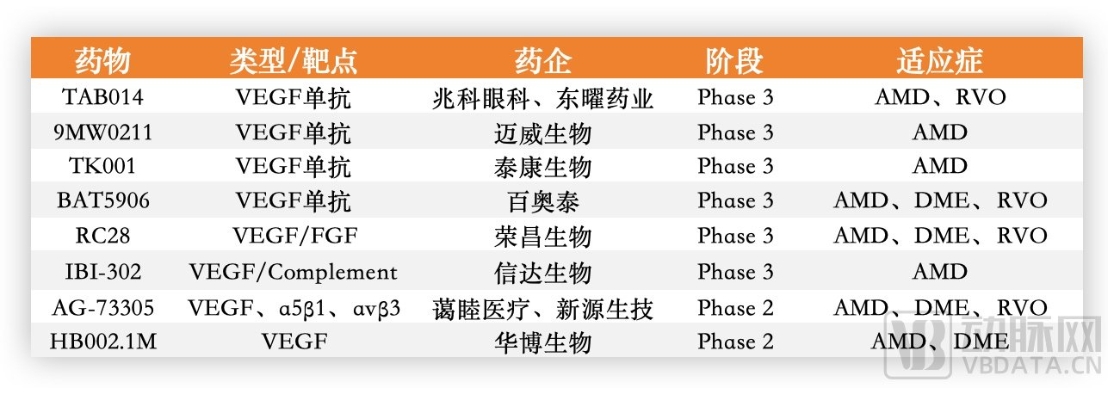
国内部分研发进度靠前的VEGF药物、数据源自企业官网
其中,兆科眼科的TAB014为国内首款处于临床阶段基于贝伐珠单抗用于治疗AMD的抗体。迈威生物的9MW0211是基于兔单克隆抗体及人源化改构技术获得的重组抗VEGF人源化单抗。百奥泰的BAT5906目前正在国内开展两种适应症的临床研究,其中治疗AMD正在进行临床3期研究。
双靶点抗VEGF药物研发中,信达生物的IBI302和荣昌生物的RC28研发进度靠前。IBI302是全球首创的VEGF与补体双靶点双特异融合蛋白,信达生物于2023年启动了IBI302对比阿柏西普治疗AMD的临床3期试验。除此之外,信达生物还有另外两条管线IBI333和IBI324处于临床1期阶段。值得一提的是,信达生物创始人俞德超曾在康弘药业主持了康柏西普的开发,独立创业后继续深耕此赛道也就顺理成章了。
RC28是荣昌生物开发的用于治疗眼科疾病的全球首创VEGF/FGF双靶标融合蛋白药物,可同时阻断VEGF和FGF家族的血管生成因子,从而更有效地抑制血管异常生长。有趣的是,创始人之一的房健民博士也是康柏西普的早期研发者,而荣昌生物的RC28与信达的IBI302是国内临床阶段仅有的步入临床3期的VEGF眼科相关双特异分子。
当然,眼科靶向VEGF领域的管线不止于此,包括基因疗法、RNA等前沿领域也有众多布局者,一些MNC如勃林格殷格翰也参与其中。眼底治疗领域的乱战,一时半会儿不会结束。




评论