文|动脉网
无论是在谋求投资机构的直接注资,还是借助License out作为维持生存的手段,出海,已成为国内创新药企活下去的必然手段。
不过,迈出国门的先行者们前途未卜,沿途的卖水人率先尝到了甜头。今年Healthcare IT发布的研究报告曾对临床试验数字化细分赛道电子临床结局评估(eCOA)解决方案进行调研,2023年的eCOA全球市场规模为14.7亿美元,预计2031年增至47.4亿美元,CAGR高达15.80%。
尽管报告未曾披露中国市场增长的具体数字,但从2023年爆发的出海热情看,国内市场的年增速有增无减。
近年来FDA一直鼓励药企采用数字健康技术(DHT)进行申办,如今美国约80%的临床研究都以eCOA的形式进行,欧洲也有60%依照这一路径。
而在中国,只有不到5%的申办方使用了eCOA,剩余95%的项目,还停留在纸质的方式。

目睹这一机遇,海内外临床试验数字化供应商加快了中国市场的开拓步伐,并在服务内容中不断创新。他们不再局限于将纸质的表单电子化,而是将深度学习、生成式AI等技术引入其中,深入创新药申办流程,甚至为他们提供直观的出海建议。
此趋势下,这批企业在创新药出海的路上发挥着愈发重要的作用,甚至有望成为创新药临床试验必不可少之力。
医药出海,九死一生
从立项到获批上市,一款创新药需要经过临床前研究、临床试验、注册上市和售后监督等诸多环节,每一环节存在失败的风险。加之出海后的陌生环境,这个过程变得凶险异常。
以临床方案设计为例。由于各个国家或地区的医疗能力、患者分布存在特异性,同一种病症,国外和国内可能有着截然不同的未满足的临床需求,对应的标准治疗和海外的标准治疗随之存在巨大差异。比如某些恶性淋巴瘤,中国对应的可能是标准化疗,但在美国、欧洲则会偏向已经上市的靶向治疗。
因此,如何精准地定位海外人群未满足的临床需求是国内申办方必须重点考虑的因素。毕竟,曾有药企未曾了解未来要对标的治疗方案,没有清晰规划疗效、安全性,走到最后才发现管线在最初的方案上便存在问题,难以通过临床试验,以至于数千万元的投入与数年的时间付之一炬。
研究计划的差异同样制约着创新药企的出海进程。美国是个移民国家,FDA对于试验入组中受试者数量、人种分布与NMPA的要求存在差距,因而申办方必须在选择试验中心时考虑人种问题。
实际上,很多国内的申办方不了解国外试验中心的实际情况,常因为不明确当地试验中心的患者分布、招募速度慢而放缓申报速度。此外,缺乏实际数据支撑入组计划,难以定位到那些表现出色的研究中心,也会导致试验在入组阶段不及预期。
研究执行过程中还存在一个更为直白的问题。由于各国国情不同,采用的质量管理方法与量表形式有时会存在一定差异。许多国内药企习惯了100%源数据验证(SDV) ,通过CRA核对纸质数据是否与系统录入数据一致,而欧美已经全面采用RBGM,侧重审查重点数据,并以患者自报结果(ePRO)形式的采集数据。
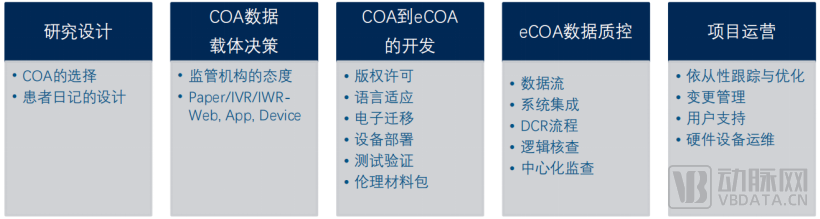
试验应用eCOA的各环节及必要考量
虽然国内许多创新药企的创始团队都拥有丰富的MNC研发、管线BD经验,但要保证自己的团队能够把握出海申报的每一环节,仍需付出相当大的试错成本。而这些成本,正是临床试验数字化企业的机遇所在。
深度介入临床试验,全新蓝海市场已经形成
将临床试验数字化市场中的产品粗略拆分可分为两类,一类是基础的临床试验信息系统类产品,另一类是基于临床试验相关数据库衍生的创新产品。在这波创新药出海的浪潮中,两类产品的市场规模都发生不同程度的上涨。
临床试验信息系统市场的市场一直处于高度集中状态,且一度趋于饱和。2021年,太美医疗、Veeva等六大厂商占据了逾2/3的市场份额,EDC、RTSM、PV等产品在试验中心的使用率已经高达90%-100%,基本做到了市场全覆盖。因此,出海导致的增量更多来源于eCOA等细分赛道。
相比于EDC、PV等产品,eCOA专注于临床结果的评估,在国内制药行业的优先级不如数据采集和合规。同时,eCOA的初始实施成本可能较高,包括系统购置、人员培训、数据迁移等方面的费用,在没有看到明确的投资回报之前,许多创新药企都对这一系统的配置持谨慎态度。
但如今出海成为一种必然,eCOA曾经的劣势成为临床试验数字化企业们的全新突破点,除了Medidata、Veeva等跨国企业加速推进之外,国内既有太美、百奥知、泰格加码,又有耀乘健康科技、铨融、一临云等初创企业布局。
再谈临床试验数字化市场中的创新产品。从实际FDA申报情况看,eCOA的配置还是比较容易得到满足,但要处理临床方案、临床计划甚至药物上市后的营销问题,临床试验数字化的服务提供者们必须有充分的海外运营经验,以解决出海后的“本土化”问题。
较于国内企业,跨国企业因其经验与背景略胜一筹,也通过产品创新不断扩大临床试验数字化的市场容量。
譬如面对上文提到的未满足的临床需求,国内创新药企的医学部门绝大多数基于已经发表的文献确定患者需求,但是,文献多是基于已经上市的药物进行撰写,研究的对象多是一个符合药物特征的特定人群。
这意味着,药企在早期规划研究策略时只能基于有限的文献发表来做临床研究中的重大决策,很难看到那些未经研究的特定人群,也不愿意花费几千万甚至几个亿的投入在这些未经数据验证的领域中去。最终,不少新药因为创新不足而在最后环节死去。
面对这类需求,一些企业已经做好了创新解决方案。其中,Medidata尝试通过借助历史临床试验数据,帮助Fast Follower找到与竞争者的差别人群,进而帮助药企更好地选择未被满足的临床需求,并判断项目的可行性。
据Medidata介绍,他们曾合作了一家试图开发KRAS突变药物的生物制药公司。这一靶点已发表的文献极少,因此该公司希望扩大对KRAS突变人群的了解,识别SoC化疗方案下目标人群未满足的医疗需求和并发症。
在具体执行时,Medidata建立了一个包含超800个KRAS突变患者数据集,并采用特定的方法检验客户提出的选定假设。最终,Medidata用了数周时间便找到了如Brain Metases等意外并发症未被满足治疗需求的领域,最终找到与竞争者的差别人群。
再谈研究计划方面,这里的竞争主要源于患者招募。美国是一个移民国家,在临床试验时尤其注重人种的比例,如对白人、黑人、西班牙人的比例存在具体要求,需要中国的申办方也依据类似的比例招募患者。
满足这样的比例要求本就困难,患者招募的激烈竞争也在进一步限制临床试验的进行。美国拥有全球4.25%的人口,却承载着35%左右的一个临床试验的患者数量需求。近年来FDA需要处理的项目不断增加,而患者数量不足,因而50%的临床研究的中心没能够按照原来的计划入组的患者,导致药企试验时间和开支骤增,甚至有不少临床试验因此放弃。
针对这一问题,很多海外的第三方研究中心都开启了遴选服务,以满足企业的全球研究选点需求。这些解决方案可用于筛选中心和预测,基于申办方试验特点和环境预测并筛选适合试验开展的中心,甚至利用数据预测确保试验能够按计划进行,并依据新的数据实现试验预测的实时调整。
国内的头部企业过去的海外布局也在近期厚积薄发。早在2021年提交招股书时,太美的TrialOS医药研发协作平台便已对接34个国家/地区监管机构的相关数据库,泰格更是在亚太、北美、欧洲等地区的 10 个国家设立海外子公司,直接瞄准了海外用户。
AI,临床试验数字化企业必须抓住的下一个关键点
无论是过去的深度学习,还是如今风靡全行业的大语言模型,每一家临床试验数字化企业都对这项创新技术尤为热情。“出海”浪潮中,对于AI技术的不同认知亦为他们带来不同的竞争力。
如果要临床试验数字化企业围绕AI进行进一步划分,太美、Veeva两家头部公司无疑可被归为同类。具体而言,两家企业均是业内鲜有能够覆盖从临床到营销领域的数字化解决方案的企业,且都将AI植入了自家的整个产品体系。
在Veeva看来,AI能够起到提高数据处理效率、优化患者招募、改进试验设计、增强数据分析精度等功能,进而降低临床试验的成本,提升项目申报的效率。因而在服务“出海”用户时能够提供更强的硬实力。
Medidata则可归为另一类企业。他们除在流程之中应用AI外,也基于AI开拓了不少新的创新应用。
2020年,FDA同意Medidata AI Synthetic Control Arm(SCA)合成对照组解决方案应用于美国临床阶段免疫治疗公司Medicenna Therapeutics一项MDNA55治疗复发性胶质母细胞瘤(rGBM)的III期注册试验。这是III期试验首次批准采用混合外部对照组,亦是AI“数据应用”中颇为典型的案例。
白细胞介素-4受体蛋白质治疗剂是MDNA55 的主要成分,能够诱使癌细胞吸收摄取并释放毒素以致免疫性细胞死亡。但由于试验受试者招募难、留存难等难题,试验开展一度陷入无人可用的困境。
一方面,MDNA55属于靶向治疗大分子,无法穿过血脑屏障,给药时必须直接传递至肿瘤,因而无法通过招募安慰剂组来进行对照试验;另一方面,复发性胶质母细胞瘤患者生存期受限,急需治疗的患者多因担心被分配进入对照组而放弃参与试验。
为了解决Medicenna的需求,Medidata首先根据MDNA55 II期试验结果为III期试验设计混合对照组试验方案,再利用自身包含700多万匿名化患者数据库构建了一个符合患者特征的合成对照组。最后,Medidata借助倾向评分匹配的统计学方法,保证AI支持下的合成对照组能与治疗组形成良好对照和平衡。
Medidata成功帮助Medicenna在接下来的III期试验中减少招募100个对照组患者,成为罕见病试验采用混合外部对照组的首创之举。这种基于AI合成对照组的应用将提升入组患者接受试验药物治疗的概率,有望提高入组率,在不影响试验科学可解释性的同时,加快试验进程。
总的来说,无论是围绕全流程展开的提质增效,还是基于特定场景创造的AI合成对照组,AI的引入都让临床试验数字化企业们更深度地介入到了新药的临床试验中,更有效地助力创新药的上市。
同时,创新药企的“出海”也将因为AI技术的不断突破而受益。更高效的临床试验数字化工具加持之下,我们或能看到更多国内的优质产品以更快的速度通过审评审批,进而让全球范围内的患者受益。




评论