文 | 氨基观察 郑晓
细胞疗法领域再次迎来了一个具有里程碑意义的时刻。
8月1日,Adaptimmune宣布,美国食品药品监督管理局(FDA)已加速批准其TCR-T疗法Tecelra上市,用于治疗无法切除或转移性的滑膜肉瘤成人患者。
Tecelra不仅是十多年来针对滑膜肉瘤的首个新型治疗选择,更在全球范围内成为首个获批上市的TCR-T疗法,这标志着细胞疗法在实体瘤治疗领域又迈出了重要的一步。
这一消息也极大地鼓舞了国内致力于TCR-T疗法研发的企业。例如,Tecelra获批的当天,香雪制药的股价就上涨了20%。而在最近的三个交易日,其股价涨幅更是接近70%。
然而,与国内市场的热情形成鲜明对比的是,华尔街对Adaptimmune的股价表现却显得相对冷淡。

在Tecelra获批后的首个交易日,Adaptimmune的股价下跌了近10%,公司市值缩水至2.99亿美元。这反映出,市场对于TCR-T疗法这一领域的首个获批产品,并没有表现出过高的预期。
这种割裂的现象,也映照出TCR-T疗法目前面临的现实挑战:获批仅仅是开始,要想在市场中走得更远,还有许多问题亟待解决。
这也提醒我们,尽管Adaptimmune已经初步验证了TCR-T疗法的潜力,但新药的开发从来不是线性发展,面对未来可能的滔天热浪,乐观中也要留有几分理性与清醒。
01 攻克实体瘤的期待
从机制来看,TCR-T与CAR-T大同小异。
CAR-T的改造是给T细胞“换头”,将T细胞取出人工安装识别肿瘤的“导航装置”CAR和免疫“启动器“后,再回输到人体内发挥精准治疗作用。
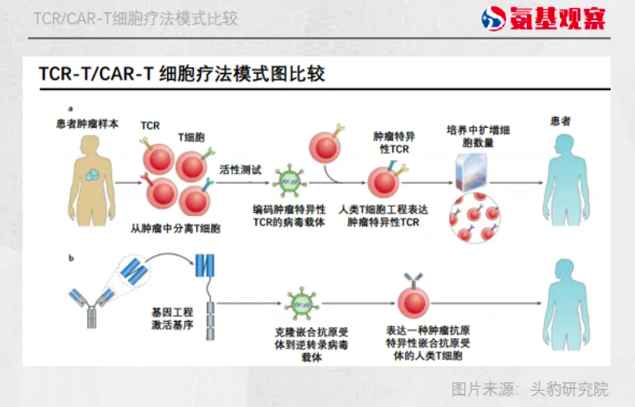
TCR-T疗法,则是直接改造T细胞结合肿瘤抗原的“探头”TCR,筛选出一些能够特异性识别肿瘤的TCR序列将其导入到T细胞中,使得原来不能识别肿瘤的T细胞能够有效地识别并杀伤肿瘤细胞。
不过,相比于CAR-T,TCR-T理论上有更高的期待。
因为,在治疗实体瘤方面,TCR疗法可能更有优势。出现这种差异的原因在于,二者识别抗原的机制截然不同。
CAR细胞识别的是肿瘤表面抗原,所以其对于表面抗原暴露程度更高的血液瘤效果较好。
而TCR可识别MHC分子呈递的细胞内抗原片段,识别的是细胞内部的癌症抗原,能够渗透到肿瘤内部发挥作用,使得TCR在对抗实体瘤时效果更佳。

并且,由于细胞表面蛋白在总蛋白中只占不超过10%,其他蛋白都在细胞内部。所以,TCR疗法可识别的靶点数量可达到90%,远超CAR能识别的靶点数量。
伴随着靶点数量增加的,是更加广阔的想象空间。TCR疗法的种种优势,吸引了不少药企加入研发。
在海外, Adaptimmune便是TCR-T疗法的引领者,此外还有Immatics、Medigene、Immunocore、Lion TCR等一众药企也在TCR-T领域不断追赶。
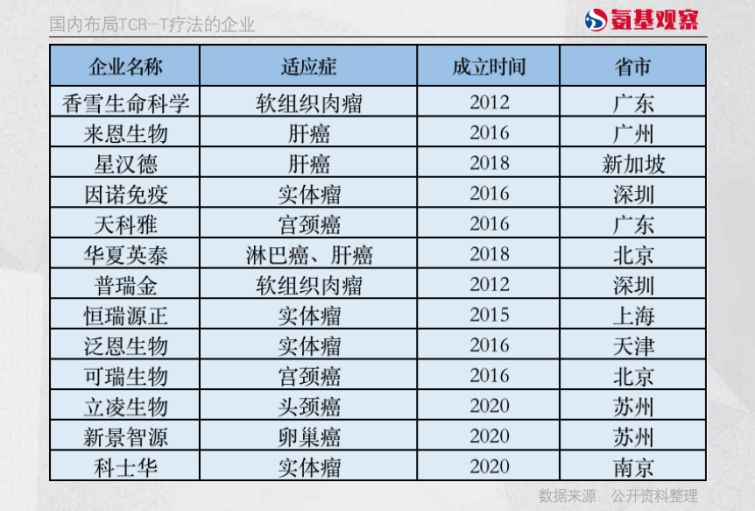
国内,同样有不少选手看到了TCR-T疗法的机会,包括香雪制药、可瑞生物、星汉德等多家企业先后加入这一赛道。
02 为TCR-T疗法正名
当然,即使是前景广阔的领域,也需要实际成果来证明其价值。CAR-T疗法之所以广为人知,很大程度上得益于像艾米丽这样的成功案例,随后多款产品陆续上市,开启了细胞治疗的新时代。
TCR-T疗法虽然理论上具有巨大的潜力,但至今还没有真正在市场上站稳脚跟的产品。Adaptimmune在这方面的意义在于,它在一定程度上为TCR-T疗法的可行性提供了证明。
Tecelra作为一种TCR-T疗法,针对的是黑色素瘤相关抗原A4(MAGE-A4)。MAGE-A4是MAGE蛋白家族的成员,在正常组织中的表达仅限于免疫特权部位,但在多种实体瘤中却有表达,包括滑膜肉瘤(SS)、粘液样/圆形细胞脂肪肉瘤(MRCLS)、非小细胞肺癌(NSCLC)等。
MAGE-A4在细胞内被加工处理,产生肽片段,这些片段与细胞表面的人白细胞抗原(HLA)一起呈递,形成被低亲和力天然T细胞受体(TCR)微弱识别的表位。
Tecelra则通过慢病毒载体转导,表达靶向 MAGE-A4 的高亲和力和特异性 TCR230 239肽片段。已经得到证明的是,这种TCR对在多种常见HLA-A2等位基因上呈递的MAGE-A4肽段有强烈的反应。
因此,在临床上,Tecelra也展现出了不错的疗效。此次获批的适应症是滑膜肉瘤,这是一种出了名的治疗难度高的疾病,传统免疫疗法对其效果有限。
目前,手术是滑膜肉瘤的首选治疗方法,一些患者会在手术前后接受放疗。但即便如此,滑膜肉瘤患者的五年生存率仍然低至20%。
尽管Tecelra尚未公布明确的疗效数据,但目前的趋势是积极的。根据SPEARHEAD-1试验的结果,44名接受Tecelra治疗的患者中,客观缓解率(ORR)达到了43%,完全缓解率为4.5%。中位缓解持续时间为6个月。在有反应的患者中,39%的患者缓解持续时间达到了12个月或更长。
正因如此,Tecelra获得了FDA的加速批准,为这一迫切需要新治疗选择的患者群体带来了新的希望。
03 仍需解决的问题
不过,对于Tecelra来说,这仅仅是成功的一小步。
从根本上讲,细胞疗法不仅是一个重视研发的领域,也是一个重视运营的领域。由于细胞疗法与传统治疗手段完全不同,它需要相应的硬件和“软件”支持。
例如,需要更专业的护理人员,他们不仅要掌握药物回输的技巧,还要熟练掌握细胞疗法的作用机制、副作用及并发症护理方法,这样才能更好地照顾患者。
对于企业来说,需要完成专业治疗中心的建设和运营,这是一个既耗时又耗力且成本高昂的过程。目前,Adaptimmune计划到今年年底有6至10个指定的治疗中心投入运营,并计划到2025年底在美国各地扩展到30个。
然而,考虑到Adaptimmune账上的现金仅有1.41亿美元,在没有其他制药企业协助的情况下,能否迅速完成运营工作的覆盖,显然是值得怀疑的。
更何况,滑膜肉瘤是一种极其罕见的疾病。在美国每年诊断出的约13400例新发软组织肉瘤中,只有5%至10%为滑膜型。换句话说,每年新增的患者可能只有几百人。
正是在这些限制之下,市场对Adaptimmune未来的商业化工作并不乐观,这也反映在其股价表现上的冷淡。
对于后来者来说,情况也是如此。他们需要在研发方面做得更好,实现更佳的疗效、更高的安全性,并探索更广泛的适应症;同时在运营层面也需做得更好,尽可能实现更广泛的覆盖。
对于国内企业而言,如果计划在国内进行商业化,还需要考虑定价问题。与CAR-T疗法类似,由于工艺等限制,TCR-T疗法的成本不会太低,这最终将反映在定价上。目前,Tecelra的治疗费用高达72.7万美元,是当前获批上市的细胞疗法中最贵的。
也就是说,目前CAR-T疗法面临的商业化障碍也是TCR-T疗法需要解决的问题。相比于期待TCR-T疗法的未来,如何思考去解决这些问题,才是当下更为关键的。




评论