文 | 动脉网
备受冷落的License-in商业模式正迎来发展拐点。
近几年,在盈利的压力下,越来越多的Biotech选择了将自研管线License-out来获得首付款及里程碑款项,增加自身现金流维持企业发展。从过去几年国内License-out的数据也可以看出,国内Biotech们License-out交易已经进入量价齐升的阶段。在今年前三季度,对外授权项目数量同比增加11笔,披露交易总金额同比增长100%。
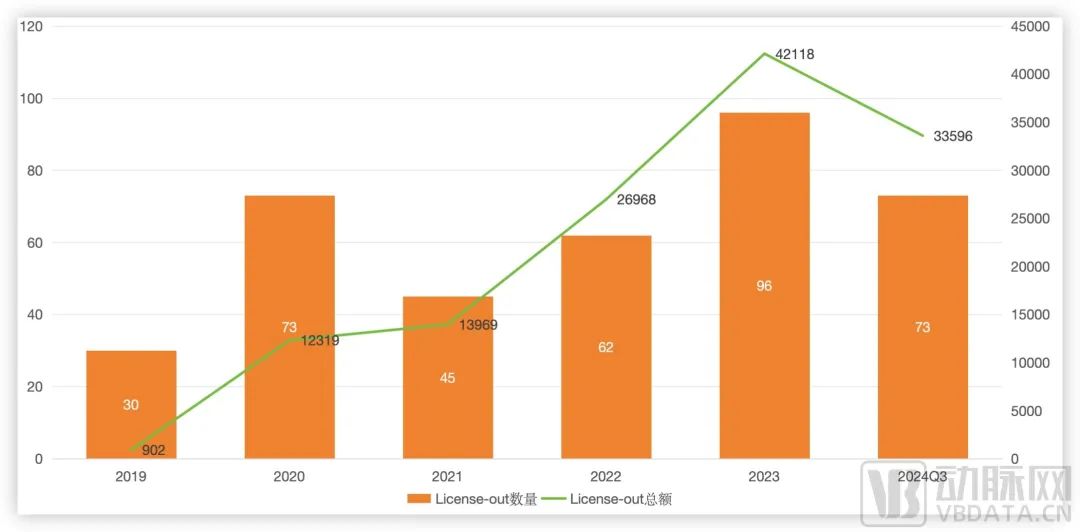
近几年国内药企License-out情况(单位:百万美元),数据源自国盛证券
更加值得注意的是,在各种对外授权交易频频爆出的当下,充满争议的License-in商业模式也开始走通,几家主打该模式的药企正以自身的实际发展,验证了该路径的可行性。
盈利是硬标准

盈利是Biotech绕不过去的话题。
无论是依靠自研产品的商业化销售,还是将管线对外授权获取首付款,Biotech正在想办法扭亏为盈,而在这其中,License-in这条路在License-out一波接一波的光环下,显得落魄不已。
之前,市场对于License-in模式存在疑问,尽管它能帮助企业快速获取管线,缩短研发周期,但这条路似乎更适合容错度更高的Pharma去走,而非风险承担能力较弱的Biotech。
现在,以云顶新耀、再鼎医药为代表的Biotech正在以自己的实际行动,证明这条路走得通。
以云顶新耀这家国内License-in模式的代表企业为例,它在2023年实现总收入同比大幅增长884%的基础上,在2024H1再次实现总收入3.02亿元,环比2023H2大幅增长158%,并且实现了商业化层面盈利。
具体来看,云顶新耀的主要营收来自于依嘉(依拉环素)和耐赋康这两款从海外引进的产品。其中,依嘉在2024H1实现收入1.34亿元,并且自去年7月商业化上市以来已经累计收入2.33亿元;而耐赋康在今年5月商业化上市之后,仅仅一个月就实现销售1.67亿元。自公布半年业绩后,两个多月的时间云顶新耀股价已累计涨超80%。
另一家主打License-in模式的再鼎医药也走到了盈利的拐点。2024年前三季度,再鼎医药实现总收入2.9亿美元,同比增加44.32%。在2021年~2023年间,再鼎医药亏损持续收窄,分别为-7亿美元、-4.4亿美元、-3.4亿美元,今年前三季度,亏损净额1.75亿美元,同比减少26.66%。
企业营收的改善也在二级市场有所体现,截至11月初,再鼎医药H股股价为超25港元,相较今年8月的12港元,已经翻倍。此外,一家主攻免疫学和炎症的跨国Biotech,Zenas BioPharma(上海泽纳仕生物)在今年9月成功登陆纳斯达克,募集资金约2.3亿美元,它所依赖的也是License-in模式。
从市场角度而言,两家企业迎来发展拐点的同时,也将License-in模式能否成功的疑问消除,打破了市场对于该模式的态度。只是,他们依靠什么来改变的呢?
做对了什么
■ 效率是成败基础
近些年,国内药企BD已经由License-in模式转为License-out,除了顺应产业发展趋势外,License-in模式自身的缺点也阻扰了企业更多的投入。

2015年~2024Q3,国内药企License-in/out项目数量,数据源自国盛证券
虽然License-in模式可以跳过药物发现阶段的风险,使整体研发难度降低,药企能够快速丰富产品管线,缩短产品上市周期等优点,但成本、临床开发、后续回报以及持续竞争力等问题依然是药企亟待解决的。
对于走License-in路线的药企来说,效率就是首要任务,只有聚焦关键业务保持高效执行力,才有可能突围成功。
以云顶新耀为例,2022年时,他将旗下仅有的一款在国内获批上市不到3个月的产品拓达维(戈沙妥珠单抗),在大中华区、韩国和部分东南亚国家的开发和商业化独家权利退回给吉利德。虽然交易获益3亿美元,但在二级市场却引发争议,股价较峰值下跌超90%。
之所以会做出这样的选择,在于云顶新耀希望避开内卷严重的肿瘤赛道,而将产品聚焦在肾科、抗感染以及自免赛道上,并且这些领域都有极大的市场空间,足够支撑起公司的营收。后来的事实也证明,当初的断臂求生是一个优秀的选择,没有业务的聚焦也不可能有业绩的逆风翻盘。
然而仅仅只有效率还不够,再鼎医药在2018年引进的尼拉帕利在当年年底就成功上市,效率不可谓不高,并且后续获批药物也越来越多,然后期待中的爆款却并没有出现。也就是说,在效率之外还需其他的因素。
■ 差异化是竞争底气
具有差异化优势的产品,商业化之路才能走得顺。
时间来到2023年,云顶新耀旗下的依嘉(依拉环素)和耐赋康分别在7月和11月获批。其中,依拉环素是全球首个氟环素类新型抗菌药物,是云顶新耀2018年从Tetraphase授权引进,此前已在美国、欧盟、英国、新加坡等地被批准用于治疗复杂性腹腔内感染 (cIAI);耐赋康则是国内仅有用于治疗成人原发性IgA肾病的对因治疗药物,是云顶新耀与Calliditas签订独家授权许可协议所得。
依嘉在上市之后获得好评,被列入2023版中国《耐碳青霉烯革兰阴性菌(CRO)感染的诊疗与防控指南》等多项临床指南和专家共识。耐赋康凭借着全球首个IgA肾病对因治疗药物的身份,被改善全球肾脏病预后组织(KDIGO)纳入了《2024版KDIGOIgA肾病和IgA血管炎临床管理实践指南(公开审查草案)》。
再鼎医药的发展拐点,同样离不开差异化产品的出现。
以2023年获批的卫伟迦(Vyvgart)为例,上市4个月便收入1000万美元,2024H1收入达3640万美元,再鼎医药也将其2024年销售指引由7000万美元上调到8000万美元。
Vyvgart是再鼎医药在2021年以1.75亿美元预付款和里程碑付款从Argenx获得,而Argenx在今年前三季度也凭借Vyvgart获得14.49亿美元的营收,其中2024Q3收入5.73亿美元,同比增长74%。
Vyvgart通过阻止FcRn与IgG结合,进而阻断IgG的再循环过程,最终缓解各种致病性IgG介导的自身免疫病。2021年便被FDA批准用于治疗抗乙酰胆碱受体(AChR)抗体阳性的成人全身型重症肌无力(gMG)。
虽然全球重症肌无力的年发病率并不高,但由于重症肌无力是一种慢性病,真实患者群体规模累加计算也已超过70万。在此之前,重症肌无力并没有特别好的靶向疗法,以非靶向的糖皮质激素、免疫抑制剂等为主,在疾病长期控制以及安全性等方面均有不足。
另一方面,随着重症肌无力创新药物上市,市场需求也在激增。据弗若斯特沙利文的数据,全球重症肌无力治疗药物市场在2020年~2025年间,将从12.6亿美元增至30.48亿美元,复合增长率达19.3%。
更重要的是,Vyvgart的潜力不止如此,Argenx希望将其适应症拓展到15项,并陆续开展了临床,而再鼎医药也在跟进,这也是其前景被市场看好的重要原因。
依嘉和Vyvgart都证明了产品的差异化是商业化顺利推进的重要基础,而如何找到具有差异化的产品则是License-in的核心能力。
■ 选品能力是支点
对License-in而言,会选固然重要,选择的时机也很重要。
不管依嘉和耐赋康作为能填补市场空缺的刚需类药物,推动了企业业绩的上涨,还是Vyvgart避开了MNC激烈竞争的肿瘤、慢病等热门领域,选择源头创新,并布局有差异化的适应症。做出这个选择的背后,却是他们对于License-in模式的深度洞察。
创新药的诞生过程都是九死一生,任何一个环节出现问题都有可能前功尽弃。
云顶新耀选择以商业化前景为标准、临床洞察为依据,通过判断药物所在领域有无巨大的未被满足的临床需求,尤其是患者需求的迫切程度,再结合药物所在市场未来的竞争格局、医生治疗方案的选择,以及产品的可及性等方面去判断。当这些因素都有相对确定的答案后,再以临床洞察去寻找合适的在研产品。
更重要的是,做出判断的时间要比市场早5年以上。
从结果来看,云顶新耀的选品能力无疑是值得肯定的,无论是依嘉还是耐赋康,即便是放弃的戈沙妥珠单抗,如无市场前景也不可能回笼数亿美元帮助企业度过新品上市前的艰难时刻。
回看再鼎医药引进的项目,虽然覆盖了肿瘤、感染、中枢神经以及自免等领域,不像云顶新耀那样聚焦,但合作对象之后陆续被MNC所收购。
如2016年,再鼎医药从Tesaro公司引进了尼拉帕利,之后在2018年,Tesaro被GSK斥资51亿美元收购。这样的情景陆续发生在Five Prime、Turning Point Therapeutics、Mirati和Karuna等合作伙伴的身上。

再鼎医药近几年主要License-in项目,据公开信息收集整理
MNC的收购无疑是对再鼎医药所引入这些项目前景的背书,也从侧面证明了再鼎医药的选品能力。
另一方面,从企业的产品管线也可以看出它们的选品逻辑。
以云顶新耀为例,肾脏疾病、感染性疾病、自免和mRNA平台是其接下来主要布局的领域,并且按照商业化阶段进行了重要安排。
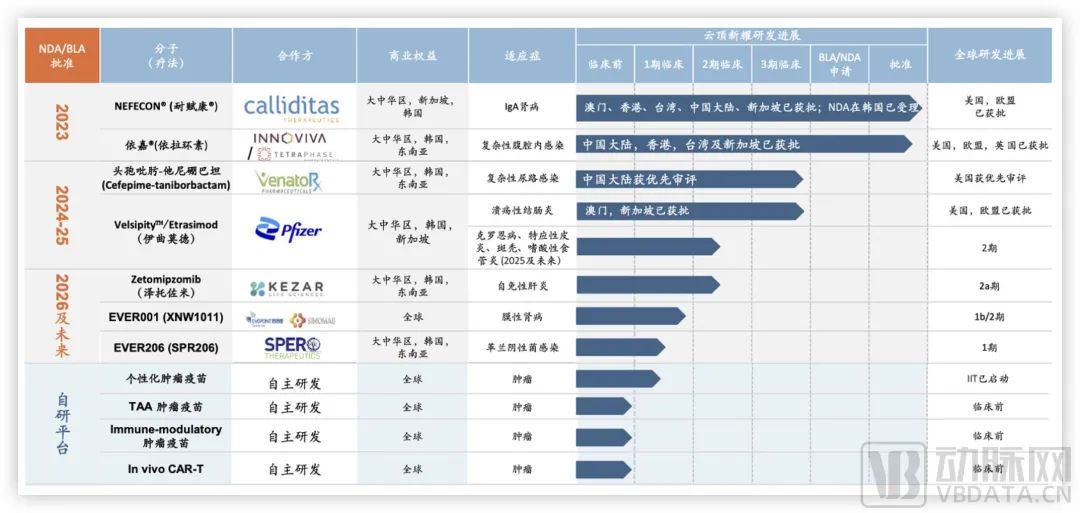
云顶新耀产品管线,图源企业官网
作为接棒依嘉的头孢吡肟-他尼硼巴坦和伊曲莫德,都已处于临床3期阶段。其中,头孢吡肟-他尼硼巴坦是一种β-内酰胺/β-内酰胺酶抑制剂(BL/BLI)抗菌药物,用于治疗选择针对由抗菌药物耐药的革兰阴性菌引起的严重细菌感染,目前其NDA申请已获FDA受理并进行优先审评,在中国也被纳入优先审评品种。
伊曲莫德则在2023年10月获FDA的NDA批准,用于治疗中重度活动性溃疡性结肠炎(UC)成人患者。同时,伊曲莫德治疗UC的亚洲多中心临床3期研究诱导期也取得了积极顶线结果,其后续研究正在加速推进。再下一阶段的Zetomipzomib(泽托佐米)和EVER001也在积极推进中。
当然,无论是云顶新耀还是再鼎医药,在License-in模式逐渐走通的情况下,也着手布局自研药物,期望今后形成“自主研发+外部合作”双轮驱动的进阶模式。
拐点已至但道路还长
虽有云顶新耀的珠玉在前,但也有联拓生物的退市在后,License-in模式要彻底走通还需解决一些问题。
如果说云顶新耀和再鼎医药在发展过程中经历了不少波折,那么Zenas(泽纳仕)的发展则是License-in模式的典型案例。
Zenas是一家主攻免疫学和炎症的跨国(美国-中国)生物制药公司,上海泽纳仕生物科技有限公司成立于2021年,其创始人兼执行董事长Lonnie Moulder,在再鼎医药、Trevena等公司任董事,还曾创立过Tesaro(被GSK51亿美元收购)。
目前,Zenas的核心产品是Obexelimab,这是一款从Xencor引进的药物。值得注意的是,Obexelimab此前就被Xencor授权给安进,而后又被安进退回。Zenas在引入Obexelimab后积极推进临床,于2023年公布了优秀的临床2期数据。
良好的数据吸引了百时美施贵宝的关注,双方签订协议在日本、韩国、新加坡和澳大利亚等地开发用于治疗自身免疫性疾病的Obexelimab并将其商业化,Zenas将获得5000万美元预付款以及百时美施贵宝的股权投资,以及潜在1.495亿美元的里程碑款项。除了Obexelimab之外,Zenas还有4个从外部引进的药物管线,也是以免疫与炎症疾病为主要适应症。
凭借着管线的顺利推进和管理层的努力,Zenas在成立3年的时间内融资了3轮,筹集了约3.59亿美元,并于今年9月在纳斯达克上市,IPO规模达2.25亿美元。
纵观Zenas的发展轨迹,有几个问题值得思考。
首先是BD能力包括以BD为目的的融资能力,本质上License-in模式就是创新药IP的供给侧竞争,参与药企的核心竞争力在于现金流是否充足,只有足够的现金流才能支撑企业走下去。
其次是临床推进能力,和MNC有足够容错空间不同,Biotech做License-in可以看成是风险投资,通过资本助力获得药物IP之后,能否快速推进进而使得管线增值是关键问题。特别是对于国内药企来说,药物从海外高价市场引入支付能力相对较弱的国内市场,如不能快速推进,则会陷入恶性循环的泥潭。
最后则是商业化落地阶段,MNC有着现成的销售团队并且能力顶尖,一旦药物获批便能快速切入,而Biotech们则是先License in产品再建立商业化团队。可此时又会出现销售网络和药品数量不匹配的状况,一个覆盖全国的销售网络仅仅销售几款药物,其成本是不可控的。因此,像再鼎医药做起了CSO业务,希望藉由代理其他产品摊薄营销团队成本。
当然,License-in模式也和市场大环境息息相关,当市场估值偏低时,License-in模式性价比更高,容易以较低的代价获得不错的管线。而市场估值较高时,License-in可能就没有自研性价比高。对于初创企业而言,License-in可以快速孵化产品,但如果单纯依靠License-in,又迟早会面临发展瓶颈。国内创新药行业经过10余年的发展,已经进入价值兑现阶段,在这个节点,License-in模式是中国创新药道路越走越宽的重要补充。




评论