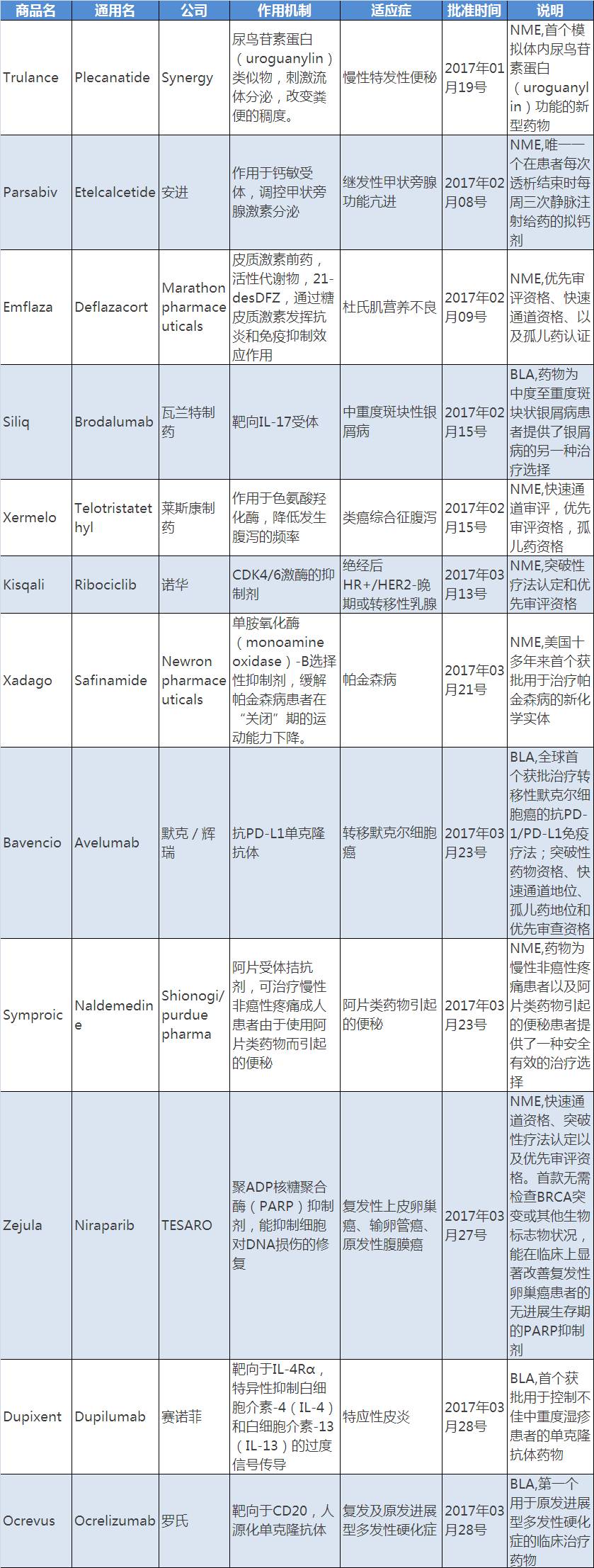
2017年是值得业界期待的一年,创先药物的开发永不会停歇,今年第一季度刚刚结束,站在4月的开端,笔者对第一季度FDA批准的药物进行了梳理,2017年第一季度,FDA共批准了12种新药(详细可见文后附表),其中包括8个新分子实体NME和4个生物制品BLA,批准数量明显高于2016年同比水平,笔者将借用这篇文章对12种药物做一个归纳和总结。

潜在重磅药物预测:
谁会是未来的重磅炸弹
年销售额超10亿美金是重磅炸弹药物的一个标签,重磅炸弹药物同时也是一个医药企业有力的竞争筹码。2017年第一季度上市的12种新药中,有几款药物备受市场关注,颇具重磅炸弹药物的潜质。Endpoint News曾发布文章,文章预测了2017年即将上市的15款重磅药物,其中诺华公司的kisqali,TESARO公司的Zejula,赛诺菲的dupixent和罗氏的ocrevus榜上有名。
1.诺华Kisqali是CDK4/6激酶的抑制剂,获得突破性疗法认定和优先审评资格,药物为HR+/HER2-转移性乳腺癌患者带来创新疗法,峰值收入可能高达15亿美金;
2. TESARO公司的Zejula是一种PARP抑制剂,药物具有同类药物无法比拟的优势,药物无需检查BRCA突变或其他生物标志物的状况,就能在临床上显著改善复发性卵巢癌患者的无进展生存期的PARP抑制剂,预测峰值收入达到17.9亿美金;
3. 赛诺菲的dupixent同样市场前景广阔,这是首个用于控制不佳湿疹患者的单克隆抗体药物物上市伊始便备受关注(详见<赛诺菲/再生元新药获批伊始便备受关注:既市场前景积极又面临专利诉讼风险>),EvaluatePharma预测2022年销售额可达41亿美元;
4.罗氏的ocrevus同样是一个改变"游戏规则"的药物,是第一个用于原发进展型多发性硬化症的临床治疗药物,有望成为二三线用药的首选,预期峰值收入39.8亿美金。
5款药物获得优先审评:
多个突破性创药物获批
FDA对创新药、突破性药物及罕见病药物采取加速审批政策,突破性疗法认定、优先审评、快速审批通道及孤儿药地位是FDA常见的加速审批措施,这对临床急需的创新药物的快速上市具有重要的意义,统计显示25%(3个新药)药物获得突破性疗法认定,42%获批药物获得优先审评(5个),33%审批药物获得快速审批通道(4个),25%药物获得孤儿药地位(3个),这对创新药物快速上市及罕见病的治疗和预防具有重要的意义。
FDA一直是世界创新药物审评审批的风向标,密切关注医药审批动态、政策创新、医药安全具有重要意义,药物美国市场的上市和市场表现对其在中国医药市场的未来走势具有十分重要的参考价值。
内容来源:CPhI制药在线(作者:Tang)
声明:该文章系转载,登载该文章目的为更广泛地传递医药市场信息,不代表新康界赞同其观点。文章内容仅供参考。



评论