11月29日晚,上市公司南京新百(600682.SH)发布公告称将以59.68亿元从母公司三胞集团收购世鼎香港100%的股权,后者持有美国生物医疗公司Dendreon的全部股权。
此次注入南京新百的Dendreon公司正是三胞集团今年6月底以8.199亿美元收购的全球首个美国FDA通过的前列腺癌细胞免疫治疗药物Provenge的研发和生产商。由于该笔交易是中国企业在美国医药领域最大收购,也是中国企业在海外收购的唯一细胞免疫治疗药物和在美收购的唯一生物类原研药,早在交易宣布时就引发报道和分析热潮。
晨哨君分别在今年1月交易宣布时和6月交割时撰文《三大难点考验:三胞豪掷8.19亿美元能否拯救TA的前列腺?》、《深度分析 | 中企首笔美国原研药收购完成交割背后的机遇与挑战》,第一时间对该交易进行深入分析。
此次三胞集团将Dendreon公司注入旗下上市公司南京新百,是中资海外并购后续整合中的一个绝佳样本,对这一案例的剖析不但有助于对三胞和南京新百的战略有更清晰认识,也是了解中资海外收购投后整合的经典案例。
募集25.5亿拓展中国市场
根据预案,南京新百除了作价59.68亿元收购世鼎香港100%的股权外,还将同时募集配套资金总额不超过25.5亿元,拟用于前列腺癌治疗药物Provenge在中国上市项目、Provenge在早期前列腺癌的应用项目、抗原PA2024国产化项目三个项目的建设运营及支付本次交易的中介费用。
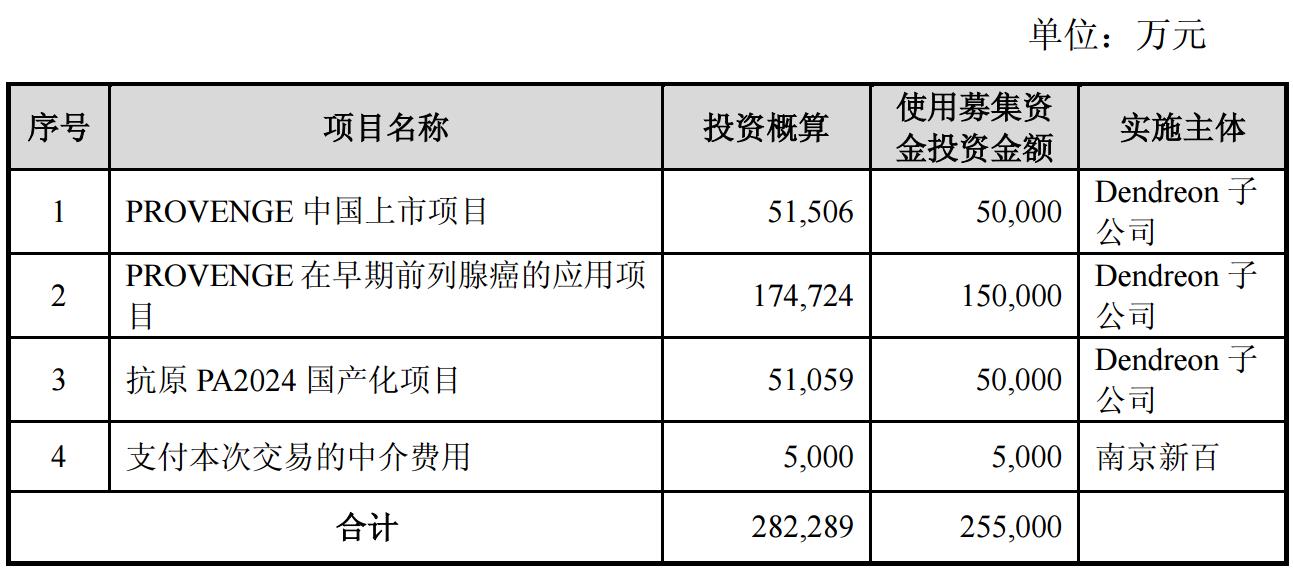
来源:公司公告
其中,5亿元将用于Provenge在中国上市,包括Dendreon公司在中国建厂、Provenge的注册申报以及上市前准入方面的投入。
南京新百预计,该项目建设完成后,我国细胞治疗前列腺癌领域的空白将得到填补。预计Provenge将在上市第一年覆盖全国20家医院,随后逐年递增,于2027年覆盖国内120家医院后保持稳定,覆盖约50%的mCPRC患者。
另有15亿元将用于Provenge在早期前列腺癌的应用,包括适应症拓展的前期临床研究和注册申报。该项目旨在将Provenge与前列腺癌主动监测方案相结合,将Provenge的适应症拓展到前列腺癌前期,扩大目标患者群,让更多的患者受益。
此外,还有5亿元将用于“抗原PA2024国产化项目”,包括厂房建设、技术开发、购买设备等方面的投入。抗原PA2024是制备Provenge非常关键的组分,此举可以降低Provenge的生产成本,提高标的公司的盈利能力。
由于Provenge上市之初Dendreon希望把更多经历花在Provenge的营销和销售上,且由于当时能够提供大规模生产抗原PA2024的选择并不多,因此Dendreon选择了Fujifilm作为PA2024的供应商。而Fujifilm与Dendreon现在的合同将于2018年12月31日到期。目前Fujifilm公司的报价为每124克3800万美元,相当于每克30.65万美元,价格相对较高。
抗原“PA2024国产化项目”建成后将解决PA2024成本居高不下的问题,也可提高对重要原料的掌控。
近60亿的价格是否合理?
对于投资者而言,有关上市公司的收购行为,最关注的莫过于价格合适与否。根据预案,此次南京新百收购Dendreon公司的价格为59.68亿元人民币,而三胞收购Dendreon的最终交割价格为8.199亿美元,此次交易仅略微增加5.26亿元人民币。考虑到因最终营运资金调整需支付给Valeant的补充交易作价、财务费用以及支付中介服务费用等因素,不到60亿元的注入价格其实并不贵。
此外,Dendreon公司的业绩在近一年也持续增长,2017年前三季度,Dendreon公司共实现营收17.74亿元,而2016与2015全年营收分别为20.71亿元、18.20亿元。前三季度营收已达到去年全年的85.67%,可以预计全年将有一定增幅。净利润的趋势与此类似,前三季度净利润已达去年全年的86.54%。
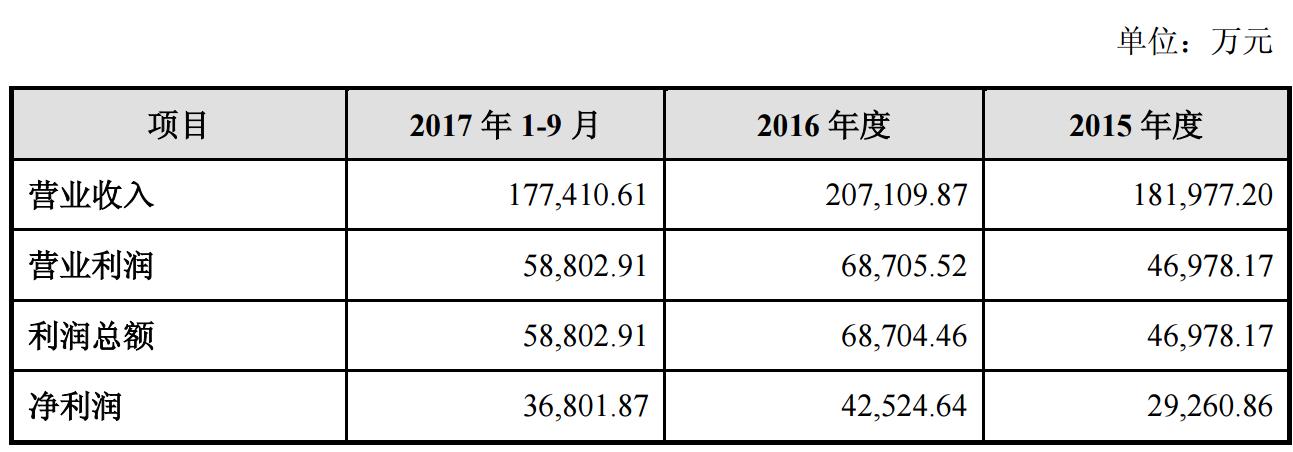
来源:公司公告
除了已有的Provenge贵为全球首个也是唯一被美国FDA批准的前列腺癌细胞免疫治疗药物外,Dendreon公司本身的研发实力也将对未来南京新百的医疗领域布局产生积极影响。据悉,标的公司目前已在进行肿瘤细胞免疫疗法在其他癌症治疗方面的研发。
Dendreon公司曾拥有三家细胞工厂,包括新泽西工厂、佐治亚工厂和加利福尼亚工厂,均按照行业顶级标准建造并获得了FDA的认证,其中加利福尼亚工厂还承担FDA细胞制备GMP培训基地的任务。2013年,Dendreon新泽西工厂出售给了正在进行细胞治疗研发初期的诺华公司,也正是在新泽西工厂,诺华制备并生产出了FDA批准的首个CAR-T产品Kymriah。足见Dendreon公司的实力。
综合以上各因素考虑,南京新百此次59.68亿元的交易价格有一定合理性。
监管规范化有助于Provenge在中国的发展
监管方面,虽然受魏则西事件的影响,去年国家卫计委叫停了细胞免疫疗法在国内的临床应用。但业内人士指出,卫计委叫停临床应用,并非是细胞免疫疗法不好,而是需要规范。国内缺乏细胞免疫治疗的标准,导致了细胞免疫治疗领域良莠不齐,一些不合规的治疗方法损害了患者的利益,同时给细胞免疫疗法带来了争议。
除手术外,放疗、化疗作为治疗肿瘤最常用的疗法,由于不良反应等方面的原因,有一定局限性。相比之下,免疫疗法是调动人体强大的免疫系统来对抗癌症,最大的优势就是可以避开正常细胞,有针对性地专门攻击癌症细胞。因此免疫疗法也被认为是最有希望的肿瘤治疗新方法,甚至被医学界认为是肿瘤治疗领域最具前景及最有可能治愈癌症的方向。
细胞免疫治疗是免疫疗法中重要的一种,而树突细胞疗法和CAR-T是目前细胞免疫治疗中最火爆的两种明星疗法。Provenge就是第一个,也是目前唯一一个被 FDA 批准上市的树突细胞肿瘤免疫疗法产品,它与CAR-T隶属于两个不同的技术类别:CAR-T即嵌合抗原受体T细胞免疫疗法,利用基因工程技术给T细胞加入一个能识别肿瘤细胞并且同时激活T细胞的嵌合抗体,利用这种强化过的免疫细胞击杀肿瘤细胞。目前美国FDA已经批准了两款CAR-T疗法,一款用于治疗急性淋巴细胞白血病(ALL),一款用于治疗非霍奇金淋巴瘤。
而Provenge并不涉及对人体基因序列的改造,是将树突状细胞(DC,目前已知的功能最强的抗原递呈细胞)在体外与重组融合蛋白(抗原)共培养,再将活化的树突细胞回输入患者体内,进一步激活细胞毒性T细胞,从而起到击杀前列腺癌细胞 的作用。
不少业内人士预测,未来监管部门将出台具体规范,保障细胞免疫疗法在国内的有序开展。2016年12月,CFDA发布了《细胞制品研究与评价技术指导原则》(征求意见稿),第一次明确了细胞免疫治疗产品的药物属性,结束了多年来细胞免疫治疗是技术还是药品的争议。
此外,就在几天前的2017年11月22日, 由中国细胞生物学会干细胞生物学分会主办,中国科学院干细胞与再生医学创新研究院承办的中国首个干细胞通用标准——《干细胞通用要求》正式发布,该标准的推出旨在推动干细胞领域的规范化和标准化发展。
随着相关部门在监管上越来越规范,预计未来国内细胞免疫疗法将更为有序的发展。这也意味着像Provenge这样在国外市场已商用数年的产品有望再国内市场获得更大的发展。
此次收购也是南京新百自2015年跨界转型医疗以来在大健康相关产业布局中的又一重要落子。目前,南京新百在生物医疗方面拥有脐带血干细胞存储,安康通、禾康智慧养老、Natali、A.S Nursing则是提供养老服务和护理服务。此外,南京新百还参设基金收购了凡迪基因。而此次收购Dendreon后,南京新百可切入目前最为前沿的精准医疗领域。
不难发现,南京新百近年来在大健康领域的布局的协同效应明显:养老企业安康通拥有超过820万老年用户,禾康智慧养老在国内也有80万的用户,而Dendreon核心产品Provenge针对的正是前列腺癌这种高发于老年男性的病种。
据南京新百内部人士透露,未来南京新百将持续向大健康进行转型,重点是干细胞研发、应用及细胞免疫疗法,力争成为细分领域的龙头企业。并利用养老、基因检测、脐带血干细胞存储等产业优势,助力精准医疗产业领域发展,最终打造出医养结合、全产业链的新健康产业平台。
附录:
Provenge的治疗原理及效果
相比放疗、化疗那些治标不治本的传统癌症疗法,细胞免疫疗法有效针对了肿瘤的复发,在不过度杀伤患者自身免疫力的同时治疗癌症。作为细胞免疫疗法的一种,Provenge利用患者自身的免疫系统来杀死体内的癌细胞。原理通俗来讲就是将患者体内的细胞(DC)提取出来,将其与Provenge制剂融合,再将其重新输回患者体内,从而使患者体内的免疫系统细胞(T)能发现并杀死癌细胞。
与常规肿瘤治疗方法相比,细胞免疫治疗具有靶向性、免疫记忆性、高效率及不良反应少且轻等多重优势。患者接受Provenge治疗,不仅生存中值提高约4.1个月,大多数病人能够延长12个月以上,而且副作用很小,类似感冒症状,1-2天即可缓解,明显改善患者生活质量。治疗期间也不排斥其它药物同步治疗。
此外,使用Provenge的患者在三年后,存活人数相比未使用Provenge的患者多出37.8%。
Provenge治疗包含3次总体注射,总治疗费用达93000美元。在美国,已进入美国医保覆盖范围,包括Medicare、Medicaid和商业保险,美国国家老年人医疗保险制度可以全额报销,75%的人群符合条件,其他患者可以报销80%以上。
Provenge在中国的市场前景
前列腺癌是男性最为常见的恶性肿瘤之一。2012年中国肿瘤登记地区前列腺癌发病率为9.92/10万,死亡率为4.2/10万人,位列男性恶性肿瘤发病率的第6,且发病率呈迅速上升趋势,年均增长率高达12.07%。伴随我国人口老龄化进程,10年内前列腺癌将攀升为我国男性恶性肿瘤的前三位。目前,在北京、上海、广州等发达城市,前列腺癌的发病率已经接近欧美发达国家,且呈现晚期患者多、死亡率高等特点。
另一方面美国前列腺癌患者平均五年生存率为99%,中国前列腺癌患者平均五年生存率仅为53.8%,存在明显差距。
中国医药生物技术协会理事、中国抗癌协会肿瘤生物治疗专业委员会副主任委员张叔人教授认为,Provenge经过临床随机分组研究,可显著延长了患者的生存期,安全性较高,作为首个被FDA批准上市的前列腺癌免疫治疗产品,为肿瘤免疫治疗做出了贡献。如果该产品和检查点抑制剂PD-1或PD-L1抗体联合应用会进一步提高疗效。我国已进入老龄社会,前列腺癌的发病率在逐渐增高,Provenge采用前列腺癌相关抗原作为免疫原,特异性好,因此该产品在男性前列腺癌高危人群中应用有可能减少前列腺癌的发病率,又能拓展成为有效的预防癌症疫苗。
显而易见: Provenge的目标市场容量呈增长趋势,市场前景乐观可期;同时引进Provenge为我国前列腺癌患者提供一种全新的生物治疗手段,有助于提升我国前列腺癌患者的五年生存率,缩小我国与国外的治疗水平差距。



评论