记者|谢欣
国家药品监督管理局官网显示,默沙东的PD-1抑制剂帕博利珠单抗(Keytruda可瑞达,K药)联合化疗用于非小细胞肺癌的一线疗法注册申请(JXSS1800018)进度已变更为“审批完毕 待制证”,这也意味着K药在中国的第二个适应症已正式完成审批,进入最后的制证阶段。
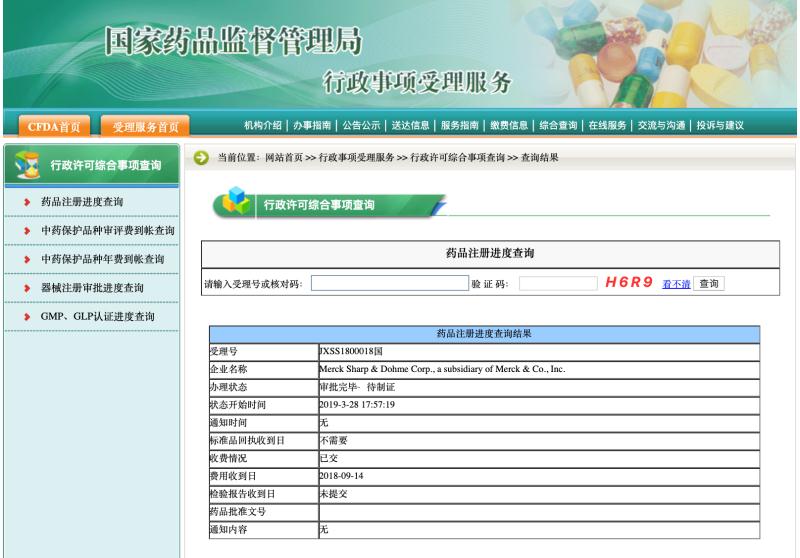
根据此前CDE信息,本次K药申报的是联合培美曲塞,顺铂一线治疗EGFR和ALK阴性的转移性非鳞状小细胞癌(NSCLC),K药由此成为国内目前唯一一个扩展适应癌种范围的PD-1产品,也是国内首个进入一线治疗的免疫疗法。目前全球范围仅有Keytruda与罗氏的Tecentriq获批NSCLC的一线疗法,后者目前在国内尚处于申报注册中。
K药此前在国内获批适应症为黑色素瘤,但其在美国的六成以上销售来源于肺癌,而肺癌作为国内人数最多的癌种,且目前NSCLC一线疗法效果欠佳的情况下,患有NSCLC的肺癌患者有望使用K药联合化疗疗法进行一线治疗。
K药本次获批是基于代号为KEYNOTE-189的临床试验,KEYNOTE-189研究是免疫检查点抑制剂联合化疗用于NSCLC一线治疗的第一个国际多中心双盲、安慰剂对照III期临床研究。
KEYNOTE-189研究的主要研究终点为无进展生存(PFS)和总生存时间(OS),ITT人群结果分析显示帕博利珠单抗联合化疗组12个月预计OS率为69.2% (95%CI, 64.1~73.8),安慰剂联合化疗组为49.4% (95%CI, 42.1~56.2);HR=0.49(95%CI, 0.38~0.64; P<0.001)。帕博利珠单抗组与安慰剂组患者中位PFS分别为8.8个月(95%CI, 7.6~9.2)和4.9个月(95%CI, 4.7~5.5),HR=0.52(95%CI,0.43~0.64; P <0.001)。帕博利珠单抗组与安慰剂组患者预计12个月的PFS分别为34.1%(95%CI, 28.8~39.5)和17.3%(95%CI, 12.0~23.5)。总缓解率上帕博利珠单抗联合化疗组为48%,安慰剂联合化疗组为19%,整体数据上看K药联合化疗优势明显。

2016年10月,K药第一个一线治疗晚期转移性非小细胞肺癌的适应症在美国获批(单药一线治疗无驱动基因突变的晚期非小细胞肺癌),随后在欧美已相继获批联合标准化疗一线治疗驱动基因阴性非鳞非小细胞肺癌和鳞状非小细胞肺癌。而在国内国家药品监督管理局在2018年批准了纳武利尤单抗(O药)用于治疗驱动基因突变阴性的晚期转移性非小细胞肺癌,但仅作为化疗失败,或不耐受化疗局部晚期或转移性的非小细胞肺癌的二线治疗药物。




评论