文|聚美丽 小 绝
1月7日,国家药监局发布了2022年第1号公告,正式宣告《化妆品生产质量管理规范》(下称《规范》)将自2022年7月1日起施行。这意味着2020年9月起草的《规范》,在历经两次意见征求后终于尘埃落定。

此次公布的《规范》是在2021年9月新版《征求意见稿》的基础上,结合行业实际情况进行优化,《规范》内容一共涉及机构与人员、质量保证与控制、厂房设施与设备管理、物料与产品管理、生产过程管理、委托生产管理、产品销售管理等板块,并对企业提出了更细致的要求。
适用范围扩大
莱博科技的质量总监池涛向聚美丽介绍道,在《规范》未出台前,工厂一直按照国家规定的“105条规定“(即《化妆品生产许可检查要点》)办事。”之前105条约束的是工厂,现在《规范》则需要行业内的品牌、企业、工厂都去遵守。“
《规范》第二条指出,“本规范是化妆品生产质量管理的基本要求,化妆品注册人、备案人、受托生产企业应当遵守本规范。”同时《规范》还提到仅从事半成品配制的化妆品注册人、备案人以及受托生产企业也应当按照本规范要求组织生产。

值得一提的是,目前还未划入化妆品范畴的牙膏,其生产质量管理也需按照本规范执行。
质量安全负责到岗到人
《规范》要求,企业应当独立设置质量管理部门,应当建立化妆品质量安全责任制,明确企业法定代表人(或者主要负责人)、质量安全负责人、质量管理部门负责人、生产部门负责人以及其他化妆品质量安全相关岗位的职责。
其中,质量安全负责人应当具备化妆品、化学、化工、生物、医学、药学、食品、公共卫生或者法学等化妆品质量安全相关专业知识,熟悉相关法律法规、强制性国家标准、技术规范,并具有5年以上化妆品生产或者质量管理经验;而质量管理部门负责人则和新版《征求意见稿》一样,删去了“大专以上学历”和“3年以上”从业经历的要求。同时质量安全负责人和质量管理部门负责人不得兼任生产部门负责人。
池涛告诉聚美丽,自质量安全人风声放出后,业内出现了“抢人”情况。因为此前质量安全人有着学历、专业、职业经验3个方面的要求,人才处于稀缺状态。而《规范》正式稿删去了“大专以上学历“要求,他认为这在一定程度上会缓解化妆品行业的人才压力。
此外,质量安全负责人应当独立履行职责,不受企业其他人员的干扰。但根据企业质量管理体系运行需要,经法定代表人书面同意,质量安全负责人可以指定本企业的其他人员协助履行以下事项:
产品安全评估报告、配方、生产工艺、物料供应商、产品标签等的审核管理,以及化妆品注册、备案资料的审核(受托生产企业除外);
物料放行管理和产品放行;
化妆品不良反应监测管理。
值得注意的是,尽管质量安全负责人可以授权具备相应资历和履职能力的人代为履行相关职责,但其应当承担的法律责任并不转移给被指定人员。这意味着,质量安全负责人仍然是第一责任人。
成品、半成品、原料都需要留样
《规范》要求,为了对产品质量进行保证和控制,企业应当建立并执行自查制度和留样制度。留样制度要求,每批出产的产品留样数量至少达到出产检验需求的2倍,并应当满足产品质量检验的要求。其中:
成品:留样应当保持原始销售包装;
半成品:留样应当密封且能够保证产品质量稳定,并有符合要求的标签信息,保证可追溯;
套盒且全部为最小销售单元:如果已对最小销售单元留样,可以不对该销售包装产品整体留样,但应当留存能够满足质量追溯需求的套盒外包装。
同时,企业还应对关键原料留样,并保存留样记录。留样的原料应当有标签,至少包括原料中文名称或者原料代码、生产企业名称、原料规格、贮存条件、使用期限等信息,保证可追溯。
强调生产活动可溯源
事实上,除了需要留样以便追溯外,《规范》还要求企业建立并执行记录管理制度,进一步强调化妆品生产活动可溯源。《规范》规定,企业记录应当真实、完整、准确,清晰易辨,相互关联可追溯,不得随意更改,更正应当留痕并签注更正人姓名及日期。
《规范》还明确指出记录的保存期限:
与产品追溯相关的记录,其保存期限不得少于产品使用期限届满后1年;
产品使用期限不足1年的,记录保存期限不得少于2年;
与产品追溯不相关的记录,其保存期限不得少于2年。
同时,《规范》还要求,企业应当建立并执行追溯管理制度,对原料、内包材、半成品、成品制定明确的批号管理规则,与每批产品生产相关的所有记录应当相互关联,保证物料采购、产品生产、质量控制、贮存、销售和召回等全部活动可追溯。
对于可溯源要求,有人表示实际操作中很难实现。而池涛却并不认同,他表示早年间莱博在生产、销售、流通等环节就已经执行溯源档案记录,什么原料、何时灌装、流向何处全部都有记录。“只要按规行事,实现可溯源并不困难。”他说道。
明确眼部护肤、儿童护肤、牙膏生产环境要求
《规范》也对化妆品的生产环境提出了新的要求。企业应当按照产品工艺环境要求,在生产车间内划分洁净区、准洁净区、一般生产区。同时明确了眼部护肤类化妆品、儿童护肤类化化妆品、牙膏品类的环境控制指标。
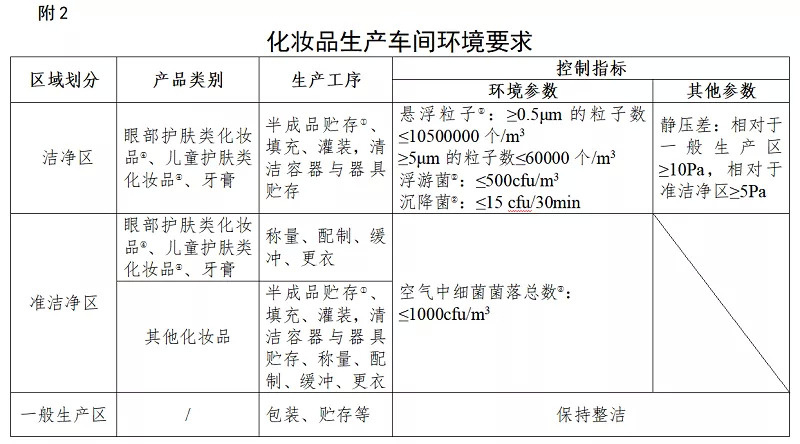
并规定了洁净区环境测试方法参照《GB/T 16292 医药工业洁净室(区)悬浮粒子的测试方法》《GB/T 16293 医药工业洁净室(区)浮游菌的测试方法》《GB/T 16294 医药工业洁净室(区)沉降菌的测试方法》的有关规定;准洁净区环境测试方法参照《GB 15979 一次性使用卫生用品卫生标准》或者《GB/T 16293 医药工业洁净室(区)浮游菌的测试方法》的有关规定。
需要注意的是,企业配制、半成品贮存、填充、灌装等生产工序采用全封闭管道的,可以不设置半成品贮存间。
历经两次意见征求后,《规范》的出台并没有让行业惊讶。“这个规范可以理解为是中国的GMPC。”大麦星球副总经理李彬表示,“此前我国没有这类的规范,但随着中国化妆品市场的发展以及化妆品法规体系的完善,《规范》的出台是意料之中。”而《规范》的出台意味着从此以后中国化妆品将和美国、欧盟、韩国等国家(地区)一样,拥有了属于自己的“GMPC标准”。
可是《规范》的出台有喜有忧,有人认为在如此细致、严苛的条例下,不少企业存在“死掉”的风险。池涛认为,一部分配置不完善、资金能力弱的企业会压力增大,甚至有的企业会被淘汰,在他看来这是新条例出台存在的必然影响。同时他认为,在大体量并快速发展的市场里,不合规、不健康的企业被淘汰反而会促进行业的良性发展。
国家药监局曾在《规范》起草说明中提到:“尽管我国化妆品生产企业发展迅速,涌现出一批知名品牌,市场份额增长显著,一些中小企业的生产质量管理体系依旧不够完善、产品的质量控制水平较低的问题仍然普遍存在,特别是企业的诚信经营和产品安全主体责任意识还有待提高。”
2021年,中国成为全球第二大化妆品消费市场。而想这个市场发展得更大、跑得更好,法规和监管就无法缺席。沉疴去尽,方能长久。




评论