文|财健道 尹莉娜 张羽岐
编辑|尹莉娜
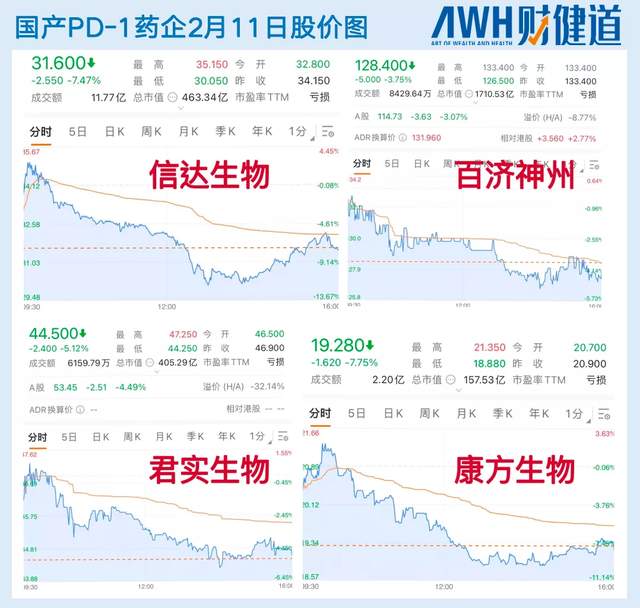
今日凌晨4时,备受瞩目的国产PD-1信迪利单抗在美上市审评问题讨论会结束,美国药监局肿瘤药物咨询委员会(FDA-ODAC)的投票以14:1的压倒性反对结果告终。
6小时后,处于“风暴中心”的信达生物火速回应,力求在公告中保留体面:“FDA没有任何对于信迪利单抗安全性和有效性问题的质疑……FDA在新药审批过程中将采纳ODAC的投票意见,但ODAC投票意见不具有对FDA决策的约束力。”
基于过去美国创新药审评的历史情况,业内普遍已经将信迪利单抗此次闯关FDA的结局与“失败”画上等号。也就是说,ODAC(肿瘤药物咨询委员会)或将影响FDA的审批决定,信达PD-1仍需进行多地区临床试验以证明其使用性。
资本市场“闻风而跌”,信达生物(01801.HK)11日收跌7.47%,其他PD-1出海企业股价同步跟跌3%以上。而受出海问题烦扰已久的信达生物,自去年11月底至今,股价已从每股73.5元降至30.55元,跌幅达58.4%,市值蒸发超600亿。
01 争议:对照组、试验终点及人群的选择
正如信达生物所言,FDA对于信迪利单抗的安全性、有效性的确没有质疑,此次讨论会也打消了关于临床数据完整性的顾虑。但美国专家关于其临床试验的其他质疑,仍不可忽略,并且值得其他本土出海者警惕。
具体包括,单一国家的临床实验不适用美国及其他国家的临床多样性;与头对头SOC(新药联合标准治疗)相比,PFS(无进展生存期)终点未必可靠等。
这些争议产生的原因在于,中、美两国对于新药申报上市的临床试验、审批要求存在差异,而信迪利单抗临床试验在开展设计之初,仅针对中国审批,如今以该实验结果赴美出海,必然受到FDA关于是否符合对方审批要求和法规的考察。
信达生物的身后,在FDA排队上市的国产PD-1还有3款,君实生物的特瑞普利单抗、康方生物的派安普利单抗和百济神州替雷利珠单抗,均已提交BLA申请。
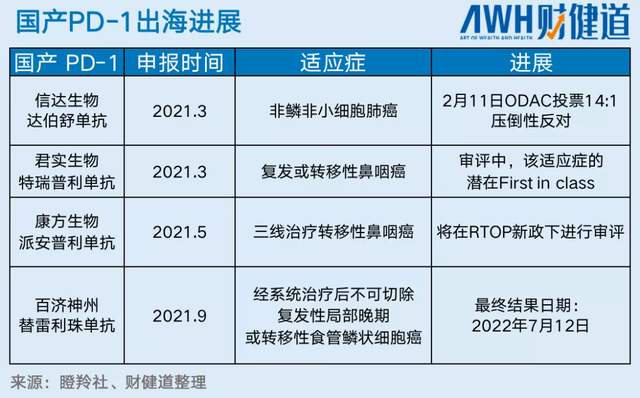
而放眼到PD-1以外的整个创新药市场,中国还有超过25款正在申报BLA的药物,其中不乏未开展国际多中心临床研究者,都将面临与信达同样的严格考核。
除了对受试者人群和试验终点的选择,美国专家对于信迪利单抗试验的对照组也表现出极大不满,这涉及到伦理审查问题。
有提问者对信达生物在美国的合作伙伴礼来(Eli Lilly)发出质疑:“礼来对剥夺患者延长总体生存期的治疗的化疗组感到满意吗?礼来进行了多少次试验,剥夺了患者获得已知生存优势的治疗方法?”
一位在场专家也表示:“我对这个问题感到非常不舒服,因为已知疗法可以改善一年以上的平均生存率,而患者却没有得到它。我希望委员会成员就这部分进行一些讨论。我知道PD-1可能当时还没有在中国市场上销售,但是由于未来还会有很多在中国或其他地区的试验采用非标准疗法作对照组,我们认为有必要进行讨论。”
简言之,对于已有更好疗法上市的适应症,如果选择了化疗或安慰剂等作为对照,是不被美专家所接受的。
虽然信达对此做出了有依据的回应——在当年K药治疗的单个患者成本高达数十万,并且能够在国内开展的医院数量甚少……如果需要使用FDA指导研究的标准统计假设(OS+头对头),这样的试验将面临重大的可行性挑战,它需要招募2,000多名患者,需要7年时间才能完成。
但这样的理由也无法再支撑今后的药企做同样选择,因为中国NMPA去年7月关于抗肿瘤药物的临床试验指导文件中也更新了这一原则,即这类情况应当开展“头对头试验”,Me-too甚至me-worse药物的泡沫将被逐一戳破。
02 本土创新药出海“宝贵的一课”
对于信达生物而言,PD-1出海受阻无疑是一大打击。但对于国内新药研发而言,却是“宝贵的一课”。
另一本土PD-1药企的内部人士告诉《财健道》,其并不认为美国FDA或ODAC在针对中国药企,本土药企应当厘清在美上市的具体标准,但其根本目的,是为了在今后将目光转向自身产品研发、试验设计等过程,以求完善和进步。
换句话说,FDA针对的,是任何钻临床试验替代终点的空子、“以次充好”走捷径的行为。倘若泡沫泛滥,医疗领域绝难承受一场“次贷危机”式的灾难。
对FDA来说,对于其本国药企上市多年的PD-1审批,也没有放松专业性底线。在2021年,FDA对罗氏阿替利珠单抗的两个适应症,默沙东帕博利珠单抗的三个适应症,以及百时美施贵宝纳武利尤单抗的一个适应症,展开了复核审查大会,最后对其中2个适应症进行撤销。
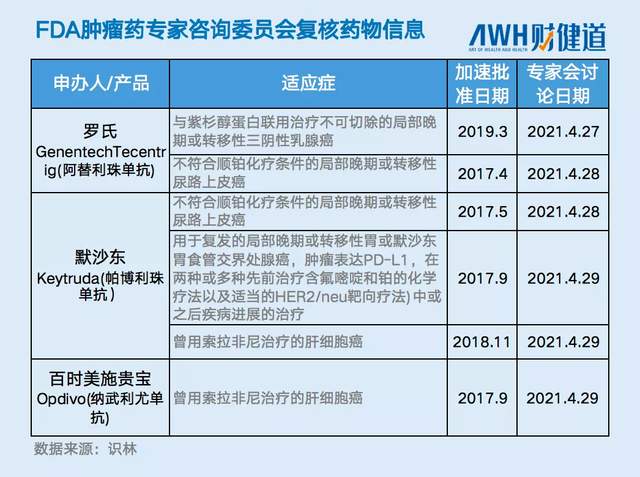
除此之外,去年3月,百时美施贵宝、阿斯利康、默沙东和罗氏四家公司与FDA达成协议、宣布撤销了另外四个新适应症的加速审批,撤销原因是确证性试验不符合上市后要求(PMR)。
所以,尽管工商业界对FDA的监管有不同看法,但对其专业能力却一致认同。许多FDA审查员是硕士或博士学位,拥有“医生、律师、分析师、科学家”等多重身份,或在大学或科研机构兼任教授。
去年6月18日,FDA发布首份患者体验数据在监管决策中使用的评价报告。作为2016年《21世纪医药法案》的一部分,第3004节要求FDA需要在2021年、2026年和2031年分别发布患者数据评价报告。
报告指出,患者体验数据应该成为患者报告结局(PRO)和临床结局评价(COA)的核心作用。这代表着,根据替代终点加速审批上市的肿瘤治疗药物们,将被要求进行上市后的确证性实验,并随时面临撤市风险。
2021年12月8日,FDA发布了《使用真实世界数据和真实世界证据支持药品和生物制品监管决策的考量因素》指南草案。当然,都是为了在药品上市后能继续观察、研究,且最重要也最关键地——进行监管。
对创新药研发来说,九死一生是常态。要在这样的常态中活下来,并且学着适应与国际标准接轨,是未来本土创新药企业最艰难的考验。
制图|李紫雅
(作者系《财经》研究员,严瑞对本文亦有贡献)
参考文献【1】信达ODAC会议纪要. 海通医药. 2022.2.11
【2】数据失真、PD-1扎堆,FDA反内卷,中国创新药企怎么办?. 财健道.2022.01.05



评论