文|聚美丽 布瓜 岚
”对'医用冷敷贴'等产品予以取消备案,公示名单见附表“、“共注销第一类医疗器械产品备案凭证36个,完成产品备案变更23个,完成生产备案变更13家”、“经我局核实,三个第一类医疗器械产品备案号予以注销,现予公布。”
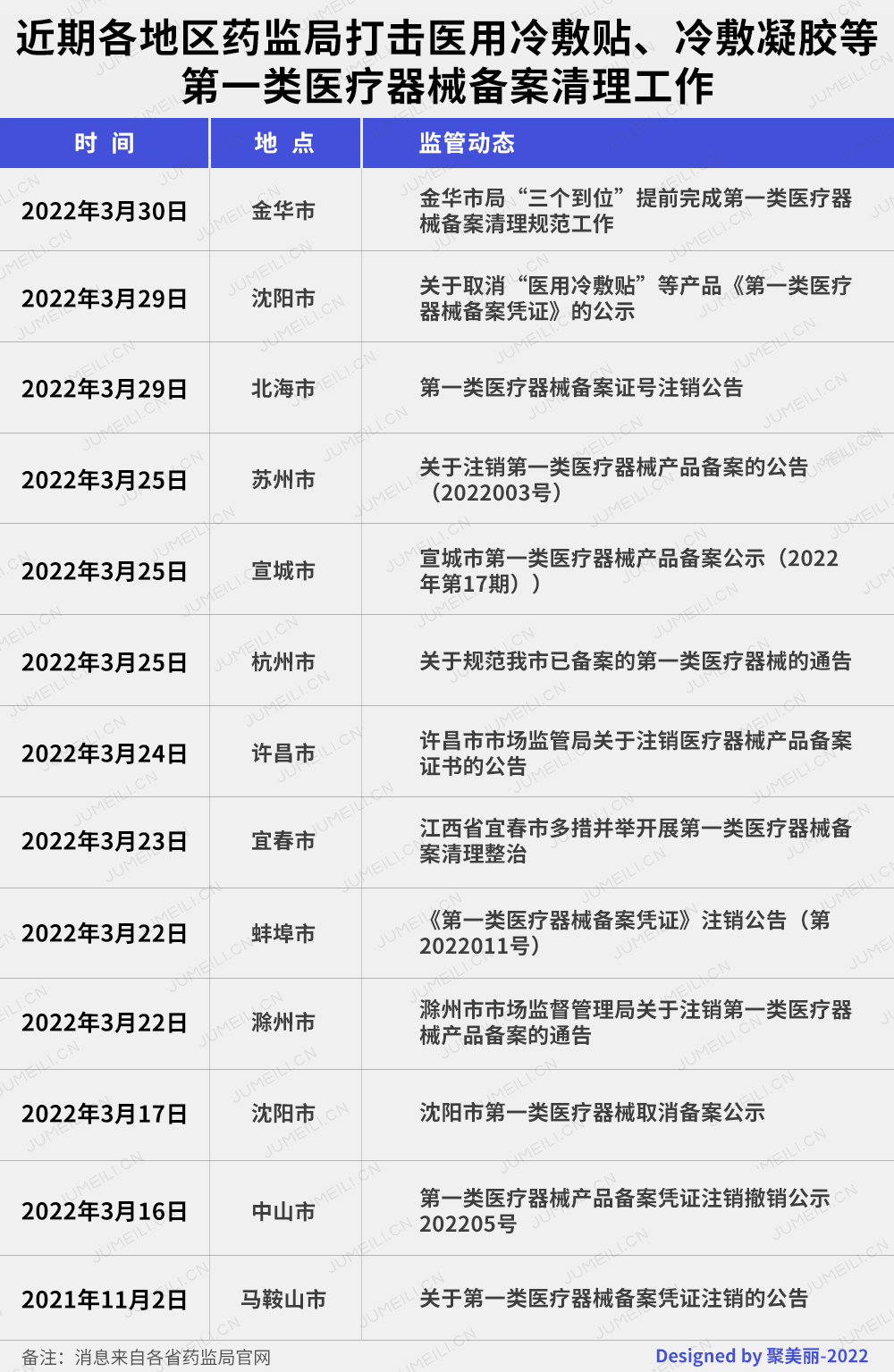
随着4月1日“大限日”的到来,金华市、北海市、沈阳市市场监督管理局纷纷发布以上公告,宣布提前完成第一类医疗器械备案清理规范工作。
而在本月早些时候,包括苏州、宣城、杭州等地市场监管局均发文表示已经取消备案的产品,备案人不得继续以第一类医疗器械产品名义组织生产;已经变更或者取消备案、但已上市的产品,备案人应当做好召回工作。
3月31日,是一类的医用冷敷贴从市场上“被删除”前的最后一天,意味着这类产品自此不复存在。
近些年来,医用敷料市场存在一些乱象,特别是2018年-2019年医用敷料刚站上风口时尤甚。市场上出现了“医用冷敷贴”、“冷敷凝胶”等产品,被不少厂商宣称为医美面膜,以区别于普通护肤面膜,特别是一些宣传中提到,“械字号面膜”就是“院线同款”。

为此,国家监管部门持续出台相关政策,严厉打击此类“医美面膜”。
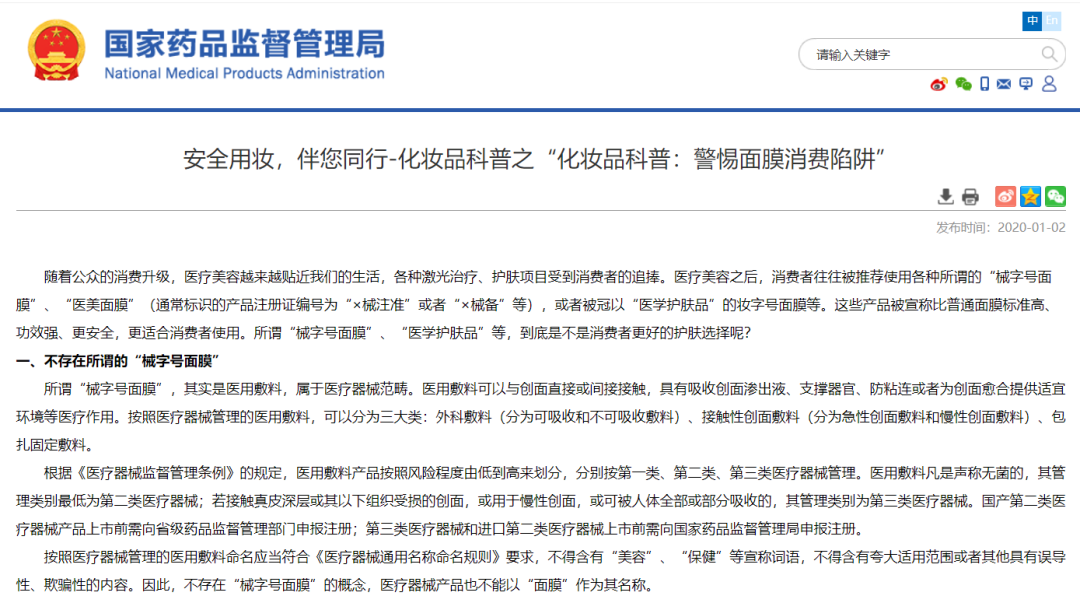
2020年1月2号:定性
2020年1月2号,国家药监局发布《化妆品科普:警惕面膜消费陷阱 》公告,指出不存在“械字号面膜”。所谓“械字号面膜”,其实是医用敷料,属于医疗器械范畴。
医用敷料凡是声称无菌的,其管理类别最低为第二类医疗器械;若接触真皮深层或其以下组织受损的创面,或用于慢性创面,或可被人体全部或部分吸收的,其管理类别为第三类医疗器械。
国产第二类医疗器械产品上市前需向省级药品监督管理部门申报注册;第三类医疗器械和进口第二类医疗器械上市前需向国家药品监督管理局申报注册。
自国家药监局发声后,全国范围内对“第一类医用冷敷贴”等医疗器械展开拉网式整顿。
2021年8月:发布医疗器械产品目录修订草案
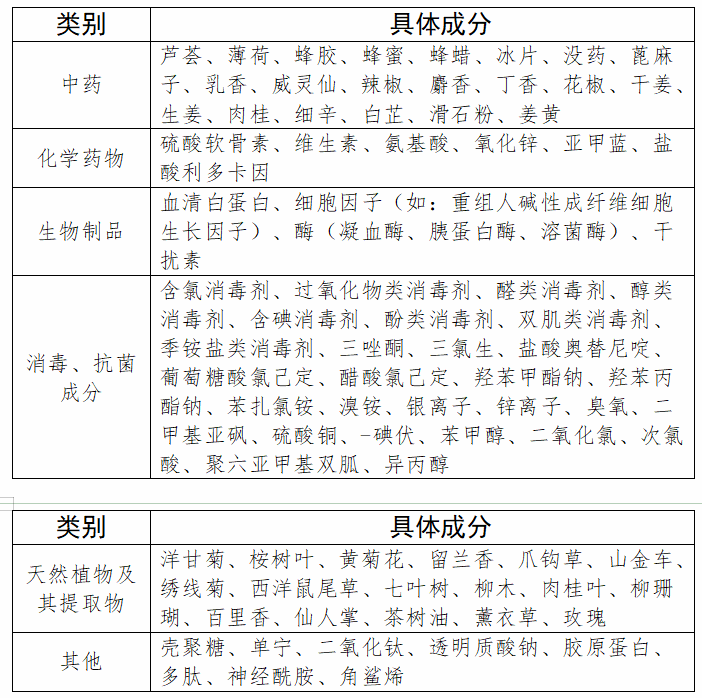
2021年8月,国家药监局发布的《第一类医疗器械产品目录》修订草案(征求意见稿)对第一类医疗器械产品禁止添加成分名录做出了规定,神经酰胺、胶原蛋白、多肽、透明质酸、玫瑰提取物、洋甘菊提取物等化妆品常见成分都拟禁止添加在第一类医疗器械中。若此次征求意见稿能够落地,对于第一类医疗器械和化妆品将会有一定的区隔作用。
2021年12月31号:明确删除品名
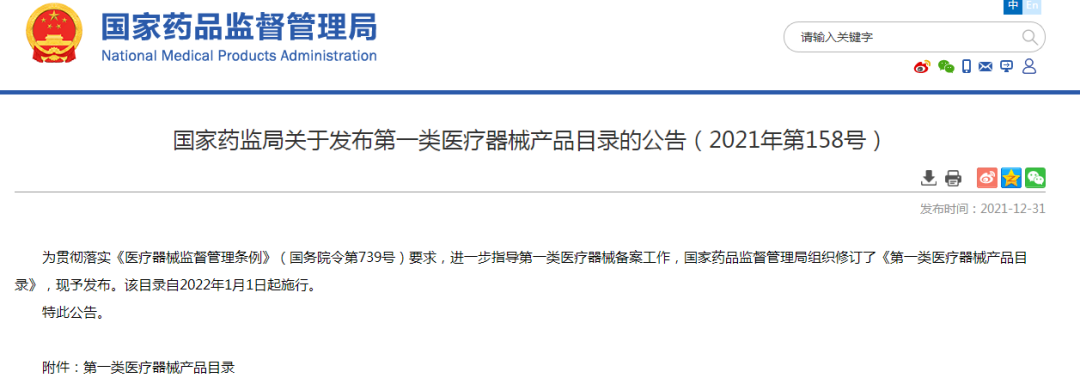
2021年12月31日,国家药监局发布“第一类医疗器械产品目录的公告(2021年第158号)”,明确删除“医用冷敷贴、医用冷敷头带、医用冷敷眼罩、冷敷凝胶”等品名,同时公布了禁用成分目录。
这意味着,第一类医疗器械中不再含“医用冷敷贴”。并且,相关第一类医疗器械也不得添加中药、天然植物及其提取物等成分。
自2022年1月1日起,所有产品应当按照新修订的《第一类医疗器械产品目录》实施备案,其中有四类产品需要在2022年4月1日前完成备案变更。

在第二类和第三类医疗器械中,企业仍可使用医用冷敷贴的品名,但比起第一类实行备案管理,二类和三类采取注册制,门槛和监管更为严格,实行注册制,分别由省局和国家药监局审批,门槛层层递进。
2022年3月2日:明确第一类责任和义务
2022年3月2日,国家药监局发布了《关于第一类医疗器械备案有关事项的公告(征求意见稿)》,向全社会公开征求意见,反馈截止时间为2022年3月31日。
药监局明确了第一类医疗器械备案人和备案部门的责任和义务。同时,为方便后续的备案工作,《意见稿》附上了第一类医疗器械备案资料要求及说明、备案表(格式)、备案信息表和第一类体外诊断试剂和备案操作规范。
其中,第一类医疗器械的备案资料包括:第一类医疗器械备案表、关联文件、产品技术要求、产品检验报告、产品说明书及最小销售单元标签设计样稿、生产制造信息以及符合性声明。
在新一版的《关于第一类医疗器械备案有关事项的公告》正式发布时,原国家食品药品监督管理总局发布的《关于第一类医疗器械备案有关事项的公告》(2014年第26号)将同时废止。
而医用冷敷贴,也同时成为历史。
参考资料:
《被模糊的边界:医用敷料与面膜到底有什么区别?》
《药监局发布意见稿,这类产品将迎来备案新依据》




评论