文|青眼
4月1日,是第一类医用冷敷贴大限之日。
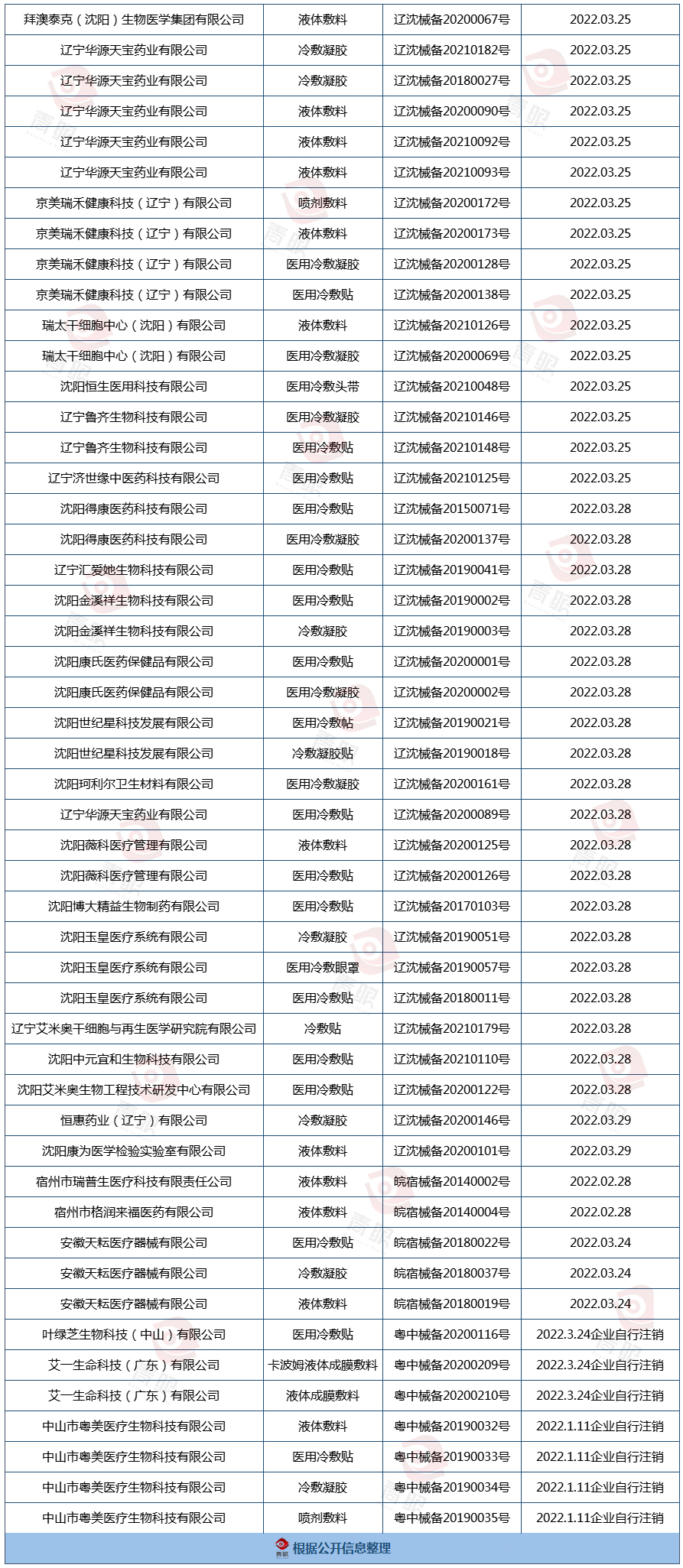
随着大限日逼近,沈阳市市场监督管理局日前公示了66个取消备案的“医用冷敷贴”等第一类医疗器械产品。经青眼调查了解到,沈阳、杭州、中山等地已有95件医用冷敷贴、敷料等产品取消备案。显而易见,第一类医用冷敷贴已经走向终局。
“医用冷敷贴”不复存在
去年底,国家药监局发布第一类医疗器械产品目录的公告(2021年第158号)(下称《一类目录》),明确删除“医用冷敷贴、医用冷敷头带、医用冷敷眼罩、冷敷凝胶”,删除“14-10-08 液体、膏状敷料”相关条目。该规定自2022年1月起施行,2022年1月1日前已完成备案的产品,需要在今年4月1日前完成备案信息变更,或取消原备案、重新办理第一类医疗器械备案。
在上述政策发布后,秉着“清理一批、变更一批、规范一批”的原则,各地方监管部门有序开展了相关第一类医疗器械备案清理工作,而被叫停的医用冷敷贴、冷敷凝胶等产品首当其冲。据青眼不完全统计,目前沈阳、杭州、中山等地已有上百件第一类医疗器械产品取消备案,其中包含95件医用冷敷贴、冷敷凝胶、液体敷料。
从时间来看,《一类目录》公告发布后,部分企业着手主动取消备案,进入2月和3月份,取消备案的产品数量明显增多,以“医用冷敷贴”命名的产品占3成。

与此同时,安徽省下辖马鞍山市、蚌埠市、宣城市、滁州市等也均公布了清理成果。如滁州全市共完成“医用冷敷贴”“液体敷料”等明确已删除产品和不规范的产品注销登记21件;蚌埠市市监局取消产品备案11个,引导企业主动转型,注销生产备案4家。
值得注意的是,根据国家药监局发布的《医疗器械分类目录》(2017年版),在二类和三类医疗器械的相关品名举例中,并没有“医用冷敷贴”,但列举了“胶原贴敷料(Ⅲ类)、医用胶原修复膜(Ⅲ类)”等。
继续销售还是召回?
取消备案即意味着停止生产,这一点无需争论,但在此之前生产的产品能不能继续上市销售,可以销售到什么时间,却困扰着不少企业。在《一类目录》发布之际,大量企业就对这些问题存有疑惑。
青眼注意到,早在今年1月18日,有人向北京市药监局咨询了这一问题,该局通过电话回复咨询人,未公开具体的答复内容。
今日,青眼致电北京药监局以了解情况,接线员告知青眼以国家药监局通告为准。而青眼多次致电国家药监局,电话一直无人接听。

某工程师判断,“应该可以销售”。华南一家工厂老板告诉青眼,他公司的一类敷贴也将在4月1日前取消备案,但已经生产的还可以继续销售至保质期结束。
不过,杭州市场监管局3月25日发布的《关于规范我市已备案的第一类医疗器械的通告》则明确指出:“已经取消备案的产品,备案人不得继续以第一类医疗器械产品名义组织生产;已经变更或者取消备案、但已上市的产品,备案人应当做好召回工作。”据上述表格,杭州有24件医用冷敷贴、冷敷敷料等产品取消备案。

械字号迎最严监管
从市场的情况来看,一类医用冷敷贴仍在正常售卖,而且依旧乱象丛生。目前小红书上部分一类医用冷敷贴宣称添加了壳聚糖、透明质酸钠等成分。但实际国家药监局在《一类目录》公告中已明确这些成分禁用于一类医用冷敷贴。

与此同时,由于医疗器械敷贴类产品的剂型与使用方式与面膜相似,而且医疗器械毛利率更为可观。根据敷尔佳的招股书显示,该公司医疗器械产品毛利率为82.79%,高于化妆品类77.08%的毛利率。创尔生物胶原类医疗器械产品毛利率高达85.95%。以上两家主营二类和三类敷贴产品,以及化妆品。
所以在一类医用冷敷贴遭到严管直至被禁的过程中,一些企业转而将目光投向二类和三类医疗器械产品。不同于一类医疗器械,二类三类实行注册制,分别由省局和国家药监局审批,门槛层层递进。某品牌方也介绍,“二类的安全性和有效性需要更加严格的管理,且生产车间的洁净度也有更高标准。”另据业内人士透露,“二类敷贴拿证大概需要1年左右。”
如果说企业严格按照医疗器械的规定生产、销售,朝着高质量方向发展应当肯定,问题是,部分商家依旧在试图教育消费者“买面膜不如买敷料”,“医美面膜”的歪风邪气也并未绝迹。譬如下图所示二类医用修复贴,内外两套标题,外标题宣称“医美修复面膜”,内标题又标注“非面膜”。
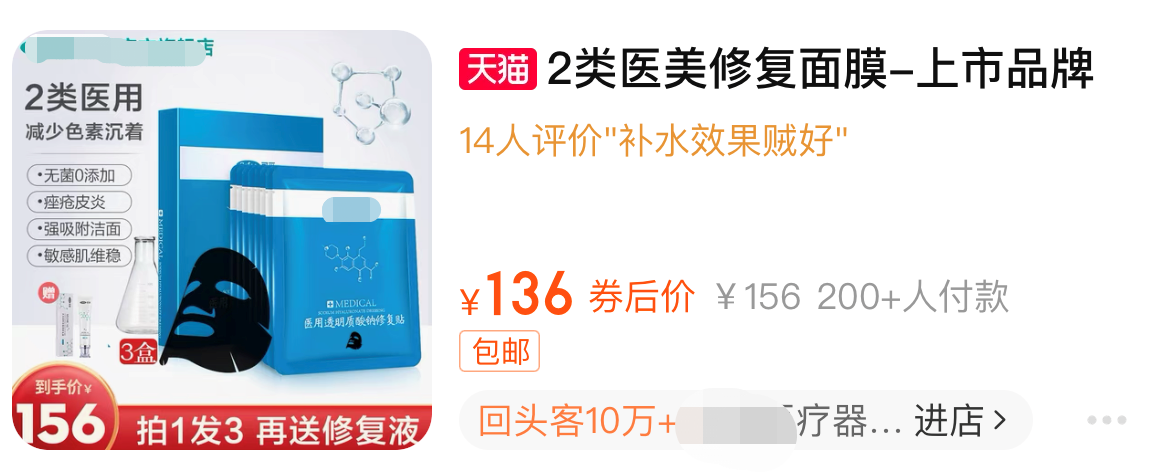

“医美面膜”搅浑了市场,国家药监局一揽子铁腕手段整治第一类医用冷敷贴,行业应该意识到此种擦边球行为不可取。“药监局曾经在前两年发过文章,图文并茂说明,没有医用面膜产品”“化妆品就是化妆品,医药是医药,不能混淆,不允许有擦边球”……不少业内人士纷纷表态。
与此同时,医疗美容平台“更美APP”主体公司北京完美创意科技有限公司(下称完美创意)去年还因此被罚。据国家企业信用信息公示系统显示,更美APP平台上部分医美机构将“医用冷敷贴”、“医用敷料”称为“面膜”,做虚假宣传,违反了《反不正当竞争法》。完美创意作为平台经营者未采取措施,最终被罚款10万。

另外,医疗器械行业也迎来了法规大年。2022年5月,《医疗器械生产监督管理办法》《医疗器械经营监督管理办法》两部法规将正式实施。国家药监局在解读《医疗器械生产监督管理办法》中提到,既贯彻“放管服”改革精神,简化有关申报资料和程序要求,也落实“四个最严”。如在现有的医疗器械生产许可和备案、监督检查、责任约谈等监管方式方法的基础上,从四个方面进一步丰富完善监管手段,并且新增两条处罚条款。

总而言之,借用行业人士的一句话来说,化妆品行业已经不再是冒险家的乐园,械字号同样也不能蒙眼狂奔了。



评论