文|动脉新医药
几乎每一种人类疾病都起源于细胞内,而小分子治疗是最简单易行的进入细胞的方法。
可以说小分子是现代制药工业的基础,但它们相对简单的同时也意味着它们很难永久治愈或逆转大多数疾病。
相比之下,蛋白质和核酸是复杂的分子,因其在基因编辑、基因治疗、RNA干扰和mRNA治疗等领域取得了突破性进展,而达到了显著的治疗效果。但让蛋白质和核酸药物安全抵达细胞内的精确靶标却成了一大难题。
所以,将生物治疗有效载荷精确输送到体内的特定细胞中成了攻克生物疗法的关键。
幸运的是,生物技术公司Sana Biotechnology通过利用名为fusogens的蛋白质,攻克了细胞内递送这一难题。
01、直面细胞内递送挑战,由团队成长到公司
在理想情况下,可以将蛋白质和核酸药物的治疗能力与小分子药物的输送广度相结合,从而将蛋白质和核酸药物输送到特定细胞内达到治疗效果。为了实现这一理想目标,需要在细胞内递送方面取得突破。
细胞内递送面临两个基本挑战:首先,需要在体内所有细胞类型中找到特定的靶细胞类型;其次,需要克服在疏水细胞膜上沉积亲水有效载荷分子的热力学障碍。
而如今的细胞内递送技术和2010年相比仍然没有实质性的进步。大多数方法都是基于合成化学衍生的阳离子和可电离脂质纳米颗粒来实现的。这些纳米颗粒瞬间穿透细胞,以便将它们的货物释放到细胞的细胞质中,但是脂质纳米颗粒几乎都被高度内吞性细胞(例如巨噬细胞)不分青红皂白地吞没,导致只有少量的核酸“货物”最终起效。
Sana的研究人员从细胞之间相互交换蛋白质、核酸甚至整个细胞器(如线粒体)的这种细胞内物质交换现象受到启发。
2016年,由Geoffrey von Maltzahn博士和Jacob Rubens博士领导的Flagship Labs的创始团队开始了一系列实验,项目命名为FL39,旨在探索细胞内递送生物学是否可以应用于解决蛋白质和核酸药物递送难题。
事实证明,细胞内递送是由一类存在于膜囊泡和包膜病毒表面的独特膜蛋白fusogens实现的。在细胞内,囊泡相互融合,使整个生物分子能够特异、高效地进入细胞的另一个膜封闭区域。
关注到fusogens是因为发现其在解决细胞内递送挑战方面具有巨大潜力:首先,fusogens具有细胞特异性,可仅与显示目标配体的细胞(例如表面受体,脂质或糖)融合。其次,fusogens还可以克服将两个脂质膜结合在一起的排斥力,并在膜融合中实现接近85%的效率,其效率比阳离子脂质高100倍以上。
在此基础之上,创始团队利用生物信息学和初级搜索的组合,建立了第一个专有数据库,其中包含不同物种所有功能和分支的20,000多种fusogens,并由此意识到fusogens可以被模块化地重新编程,以潜在地靶向人体内的任何细胞类型。这一发现使利用fusogens解决细胞内递送挑战成为可能。
2016年晚些时候,FL39更名为Cobalt Biomedicine。 目标是开发Fusosome Therapeutics:第一个释放细胞内疗法全部潜力的生物药物。Fusosome Therapeutics能够将生物治疗药物直接输送到细胞质中,还能以受体特异性的方式融合到细胞中,从而减少药物的损耗,提高利用率。
Fusosome Therapeutics由两部分组成:一是囊泡腔中的治疗效应器,例如基因疗法,基因编辑蛋白,mRNA或其他特定的生物分子;二是囊泡表面上的工程化引信原,作用是靶向并催化与特定细胞类型的融合。
到2018年年中,Cobalt团队已发展到超过35人,也逐渐趋于成熟。团队发现并设计了可以将有效载荷传递给五种细胞类型的技术,其特异性比其他技术(如脂质纳米颗粒)高几个数量级。
基于此进展,Von Maltzahn和Rubens开始寻找Fusosome Therapeutics开发所需的创业团队,或许是命运使然,让他们遇到了Sana。
彼时,Sana正在组装干细胞、免疫沉默和制造技术的组合,这些技术都可以作为对Cobalt平台的补充。
Cobalt和Sana于2019年初正式合并,继续沿用Sana的名字。新公司拥有修复或替换体内任何细胞的综合专业知识,并具有研究、开发和制造能力,支持细胞的体内和体外工程。
02、三个愿望即公司三个研发方向
Sana正在建立细胞和基因治疗领域的差异化能力,希望找到对结局不良或当前无法治愈的患者进行治疗的方法。因此在工作中,始终有三个愿望指导着Sana:
1.修复和控制体内任何细胞中的基因
Sana正在加大投资关于递送和基因修饰能力的研发,以推进新颖的传递技术,其目标是能够以特定、可预测和可重复的方式将任何有效载荷传递至任何细胞,最终达到重编细胞的目的,包括DNA、RNA和蛋白质,从而为下一代体内基因治疗铺平道路。
2.替换体内的任何细胞
即在体外大规模制造细胞以替换体内任何受损或缺失的细胞。干细胞生物学和免疫学的融合表明,通过技术能够在体外将体内多能干细胞分化为免疫隐蔽的功能性细胞,从而取代体内缺失或受损的组织。基于免疫学专业知识,可将同种异体细胞(来自供体的细胞)或运载工具从免疫系统中隐藏起来,以使身体不会排斥或消除细胞和运载工具。
3.开发相应的技术,消除治疗的障碍,让Sana的疗法成为可能
规模化、经济高效的制造解决方案,以及发现和开发新技术,使细胞和基因工程的应用范围达到最大。Sana期望未来有更多的人使用其疗法。
Sana的所有产品管线都基于这三个愿望展开,所以这不仅仅是Sana的三个愿望也是Sana的三个研发方向,更是Sana前进的目标,甚至Sana的核心技术也对应着这几个愿望。
由第一个愿望为核心发展起来的体内疗法,和以第二个愿望为核心发展起来的体外疗法,均已取得巨大进展。
03、核心技术——体内疗法和体外疗法并重
Sana正在开发可以修复和控制细胞中基因或替换体内任何细胞的平台。
从具体的疗法来看,Sana的技术可以分为两类,一类是体内疗法,一类是体外疗法。
体内疗法(体内细胞工程)
Sana的体内细胞工程平台旨在为患者提供当前基因疗法无法解决的治疗方案。
在体内疗法方面,Sana期望使用其细胞编辑平台,治疗由于基因缺陷引起的遗传病。其关键在于将细胞进行各种精准的基因编辑(编辑基因,编辑碱基,插入基因,控制基因表达等),并将这些细胞以任意载量送入人体内的任意一个部位。
成功的体内细胞工程依赖于三个核心组成部分:递送、基因修饰和执行。
递送:以特定、可预测和可重复的方式向任何单元递送任何有效负载的能力。Sana在此领域的早期重点是开发新技术和建立该领域的内部专业知识。
基因修饰:基因编辑、碱基编辑、基因插入和控制基因表达的能力都会影响多种疾病。Sana专注于建立该领域的内部专业知识,并与该领域的其他公司合作使用重要技术。
执行力:制造一致且可扩展的产品,进行智能临床试验以及与所有利益相关者合作的能力对于将药物带给患者至关重要。
目前整个体内细胞工程管线均处于临床前阶段。Sana 计划2022年提交体内 CAR-T IND,预计未来每年提交 2-3 个 IND。
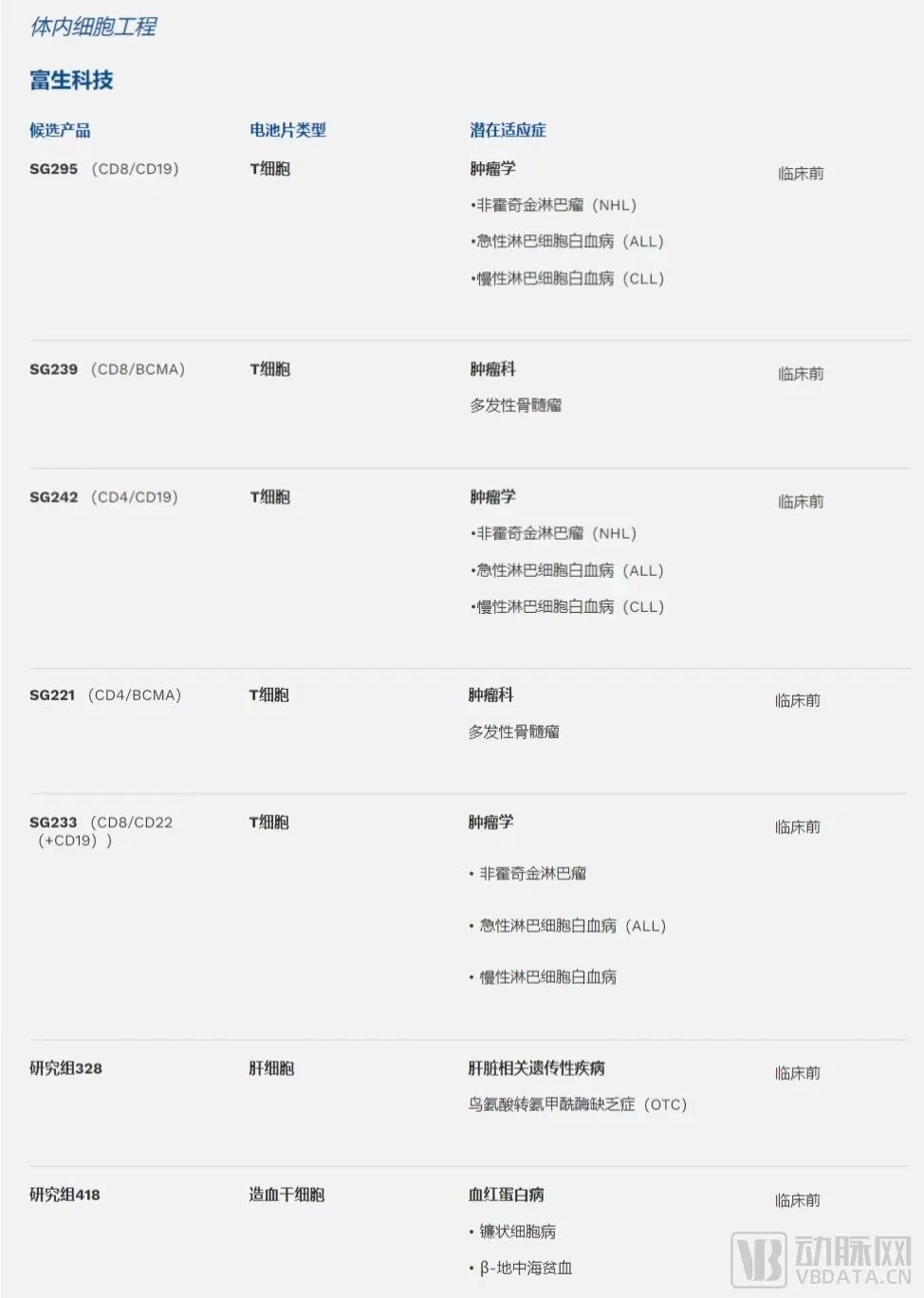
体外疗法(离体细胞工程)
在体外疗法方面,Sana希望能将干细胞分化成临床上所需要的各种细胞类型,用来替换体内的受损细胞,从而改变许多疾病的治疗。
Sana的工作在于:通过细胞的特性,结合它们生存所需要的微环境,开发正确的细胞递送技术,并在移植入人体后克服免疫排斥和细胞死亡等问题。
该领域的主要挑战是大规模制造合适的细胞,然后让它们植入,发挥作用并持续存在。而在这个领域制造有影响力的药物需要在所有这些组成部分上取得成功。
植入= 开发正确的递送系统,了解潜在的微环境,并确保细胞具有正确的特征
功能= 理解并可重复地制造所需的确切细胞
持续= 克服免疫排斥和细胞死亡
最具挑战性的障碍是克服移植"非自身"细胞的免疫排斥反应。Sana已经组建了一支由该领域的专家学者组成的团队,克服免疫排斥反应的成功将使细胞治疗产品广泛普及,目前的所有产品仍处于临床前阶段。

将干细胞分化为临床所需的细胞类型有可能改变治疗多种疾病的方式,细胞替代疗法提供了将这一愿景变为现实的机会。也许我们可以等到那么一天,等到恢复心脏病患者的心肌、重塑帕金森病患者的神经元、修复肝炎患者的肝脏细胞都成为现实的一天。
如果说Sana的体内疗法和体外疗法是对标公司三个愿望的前两个,那么对于第三个愿望的努力就可以体现在Sana 还致力于创新基因和细胞疗法的大规模生产和分销方式。
如今,Sana在剑桥、马萨诸塞州、西雅图和旧金山的工厂拥有200多名员工,公司拥有科学知识、创造力、严谨性和专有技术,通过治疗细胞内疾病来改变医学。
对于Sana来说,未来的路还很长,但是已经看到了星光。



评论