文|化妆品观察
继国家药品监督管理局发文表示,上海地区化妆品企业可延期8个月提交产品资料补录、功效宣称依据摘要等信息后,各地也纷纷响应了这一政策。
4月29日,广东、江苏、北京、重庆、浙江等五地药监局,接连发布了关于疫情期间化妆品备案管理有关事宜延期的通告。
“大限”延长,多地发文响应
按照此前规定,2022年5月1日是化妆品企业提交产品资料补录、证明文件的最后期限。在原注册备案平台已经完成备案的化妆品,备案人应当通过新注册备案平台提交产品执行的标准、产品标签样稿,并填报国产普通化妆品的产品配方。
4月27日,国药监局发文回应上海药监局,明确将化妆品企业资料补录的截止时间延期,从5月1日延迟到了12月31日。彼时,就有行业专家向化妆品观察表示,这一政策不仅仅针对上海,后续或将对全国受疫情影响的省区适用。
没想到,这句“预言”仅在两天后就落地实现了。今日,广东、江苏、北京、重庆、浙江等五地也采取了同样的延长措施。
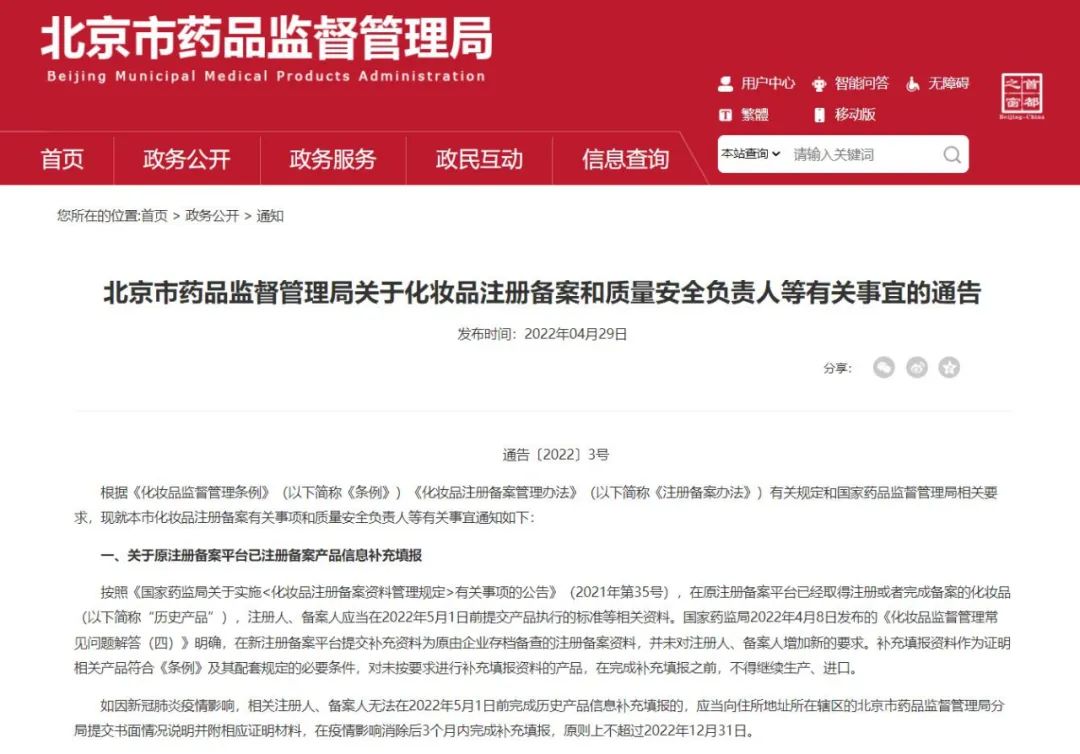
其中,广东、江苏、北京和重庆药监局发布的相关通告提到,“如因疫情影响,相关备案人、境内责任人无法在2022年5月1日前完成产品备案资料补充填报,企业应当向所在地市级药品监管部门提供书面情况说明,在疫情影响消除后3个月内完成,原则上不超过2022年12月31日。”
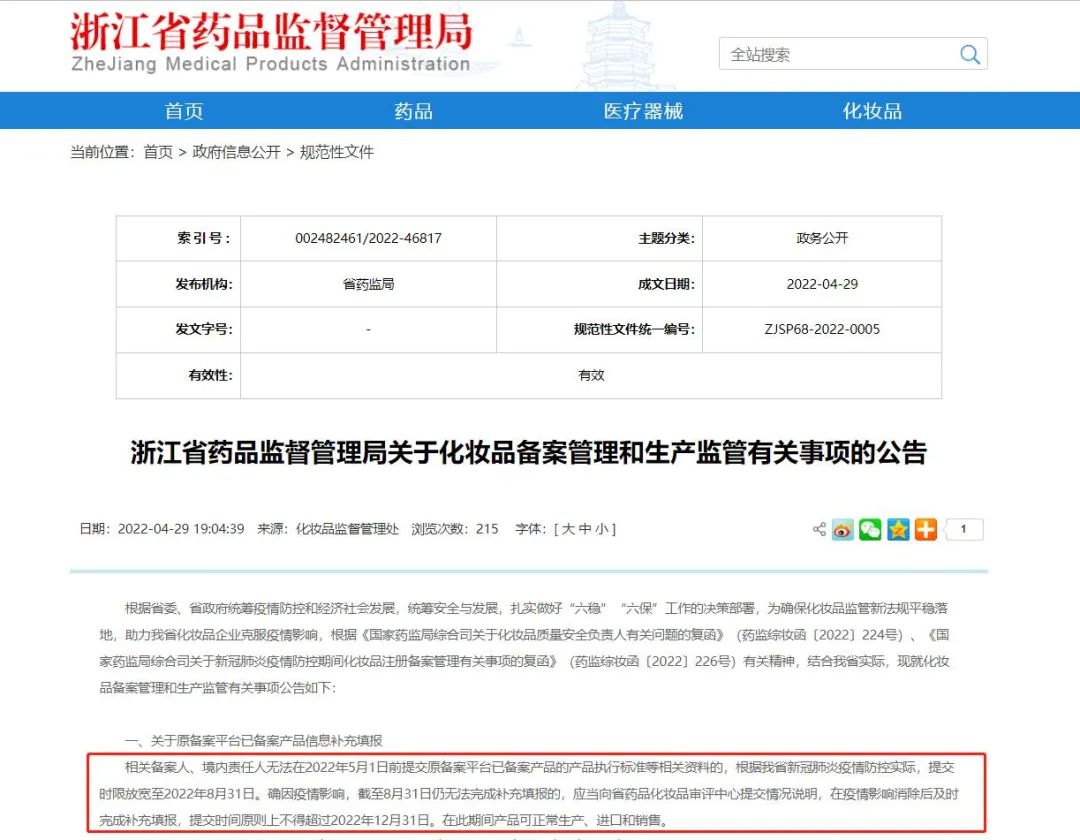
浙江省药监局则提出了两个节点,第一个是将提交时限放宽至今年8月31日。第二个是确因疫情影响无法完成补充填报的,应当向省药品化妆品审评中心提交情况说明及时完成补充填报,提交时间原则上也不得超过2022年12月31日。
关于产品功效宣称依据摘要的限定时间也同样延长。多地药监局发文均表示,对2021年5月1日至2021年12月31日期间完成备案的化妆品,如因新冠肺炎疫情影响,导致相关备案人、境内责任人无法在2022年5月1日前上传产品功效宣称依据摘要的,应当向所在地市级药品监管部门提供书面情况说明,在疫情影响消除后3个月内完成产品功效宣称依据摘要上传,原则上不超过2022年12月31日。
此外,针对质量安全负责人的资质要求,多地也迎合国家监管部门要求,放低了准入门槛。上述已发布通告的药监局均提到,化妆品质量安全负责人在具备化妆品质量安全相关专业知识的前提下,其所具有的药品、医疗器械、特殊食品生产或者质量管理经验可以视为具有化妆品生产或者质量安全管理经验。
因地制宜,浙江拟纳入信用档案
整体来看,尽管各地通告的内容大体一致。不过各地结合当地实际情况,也因地制宜做出了一些差异化举措。
比如,针对“资料补录和产品功效宣称依据摘要上传”事项,上海、北京均提到,要向所在地区市场监管局提交书面情况并附相应证明材料,而江苏、重庆、广州药监局仅要求“提交书面情况说明”。
此外,浙江药监局还特别提到了“关于化妆品备案资料容缺受理”,即对于因疫情影响无法提供加盖印章的备案资料、或者境内责任人授权书及其公证书、境外化妆品生产质量管理规范等证明性文件书面原件的,采取“容缺受理”措施。
具体表现,“备案人、境内责任人可先行提供相关复印件或电子版文件,并附经企业法定代表人(主要负责人)确认的情况说明,提交至备案平台。待线上审核通过后,可予先行开通用户权限。加盖公章的电子资料和纸质资料原件应当在疫情影响消除后及时上传补交”。
针对未在要求时间内完成资料补录工作的处罚措施,北京、浙江药监局延续了国家此前公告的要求,即未在顺延期限内完成补充填报的,将被责令期限改正。如在责令改正期内完成补录的,可以继续生产、进口。如相关产品不再生产或进口,相关备案人未计划补充填报的,应当在改正期限内主动申请注销备案产品,已上市产品可销售至保质期结束。逾期不改正的,将被取消备案。
而浙江在上述要求之外,还强调了“对未按时上传功效宣称依据摘要的依法予以处置,并纳入企业信用档案”。

截自《浙江省药品监督管理局关于化妆品备案管理和生产监管有关事项的公告》
“该办不办,该补不补,纳入信用档案,从严监管。”某业内人士表示,浙江地区对于产品资料补录、功效宣称依据摘要等要求的“时限更明确,容缺资料更具体”。
“意料之中”
对于此次全国多地药监局发布通告的动作,多位行业人士表示,“没有感到太意外。”
“都是同一个行业,之前上海发声得到了回复,全国肯定是一样的。”广州李记包装材料有限公司总经理李道扬如是表示。
同时他也指出,这对于很多企业来说确实有帮助,“我们就有客户的包装原本来不及出货,但时间放宽之后,就可以安排出货继续销售了”。
“多了8个月时间缓冲,就不用那么赶了。”广东尚品汇化妆品股份有限公司彩妆研发主任林丽隽也表示,按照原限定时间,对于不再开展相应功效宣称评价的备案产品,应当及时进行变更或者注销,但注销则需要工厂和品牌公司同时操作,联系不上的客户很难如期完成。
另外,也有不少行业人士表示,相关规定早在去年就已发布,做好了充足的准备工作。霸王(广州)有限公司副总经理汪亮就说道,“该做的都已经做了,这次的政策对霸王影响不大,但放宽条件总归会好一点。”
与此同时,还有业内人士认为,该政策对于企业而言虽有一定帮助,但“还不够开放”。
根据《化妆品功效宣称评价规范》,2021年5月1日至2021年12月31日期间取得注册或者完成备案的化妆品,化妆品注册人、备案人应当于2022年5月1日前,对化妆品的功效宣称进行评价,并上传产品功效宣称依据的摘要。这意味着,监管部门为此期间注册/备案的产品设置了近一年的过渡期,可以“先备案后补功效评价”。
这次因疫情影响而延长上传产品功效宣称依据摘要的时间,也针对的是这批产品。而从今年1月1日起注册/备案的产品,则不存在“过渡期”。
在李道杨看来,过渡期只是时间问题而已,但是新法规对企业的影响还是一样的。
广州尊伊化妆品有限公司创始人陈来成也直言,“若继续采取过渡期措施,对很多企业来说能缓解很大压力。如果新规不放松,未来还要倒闭一大批化妆品企业。”
据其透露,目前受疫情和检测机构爆雷的双重影响,产品的功效评价无法推进,因此无论是老品牌还是新品牌产品上新都很困难。“近两个月以来,备案多的产品基本上都是免功效的”。
和麦贺达集团副总裁田黎明也认为,目前的政策或还远远不够。他表示,当前很多企业对市场、政策等信心不足,备案的热情很弱。“备案等于新品投放预期,新品等于老板们的经营信心,若品牌都不想投放新品了,市场就缺少活力和动力了。”



评论