文|财健道 吴妮
编辑|杨中旭
制图|刘正
6月6日,在全球药企一同秀肌肉的ASCO大会上,罕见出现了全场起立鼓掌的一幕。
此时站在台上的主角是阿斯利康(AZN)和第一三共共同研发的Enhertu(DS-8201,简称T-DXd)。
阿斯利康和第一三共汇报了DESTINY-Breast 04研究结果,显示T-DXd在HER2低表达领域的重要突破:与医生选择的化疗方案相比,T-DXd将HR阳性、HER2低表达转移性乳腺癌患者的疾病进展或死亡风险降低了49%。T-DXd治疗组患者的中位PFS为10.1个月,而化疗组患者为5.4个月。
HER2低表达患者在整个乳腺癌中占比45%-55%,但此前没有单独分类,而是被归为HER2阴性的亚型中。HER2基因是乳腺癌重要的驱动因子之一,一直以来,乳腺癌的靶向药治疗仅限于HER2阳性(免疫组化3+FISH扩增),从曲妥珠单抗单靶、双靶(曲妥珠单抗和帕妥珠单抗),再到T-DM1(ADC药物),不断升级。而HER2阴性患者缺乏靶向药物的治疗。
DESTINY-Breast04研究像平地一声雷,给HER2低表达这一未被满足的治疗需求带来更多希望。
“现在有了T-DXd,HER2低表达患者将回归大众视野,得到单独审视。” 海南省肿瘤医院乳腺科专家蒋锐认为,既往的HER2阴/阳性的分类,以后可能会改成HER2低表达、HER2中表达和HER2高表达。
除了HER2低表达,阿斯利康/第一三共开展了八项DESTINY-Breast系列研究,在DESTINY-Breast 04之前的三项研究结果,分别验证了其用于HER2阳性乳腺癌的后线治疗、T-DM1经治的HER2阳性晚期乳腺癌患者治疗、HER2阳性晚期乳腺癌二线治疗的有效性和安全性。
不仅是乳腺癌领域,T-DXd在胃癌也有不俗的表现,可谓多面开花。
T-DXd是怎么做到的?给国内布局ADC的企业带来哪些警示?
01、T-DXd凭什么赢得满堂彩
T-DXd的神奇之处要从ADC药物的特性说起。ADC药物是在单体药物基础上,用某种特定的连接物(Linker),以特定方式将小分子细胞毒药物()结合起来。这样既能保持单抗药物的高特异性,又不丢失小分子药物的高活性,从而提高肿瘤药物的靶向性、减少毒副作用。
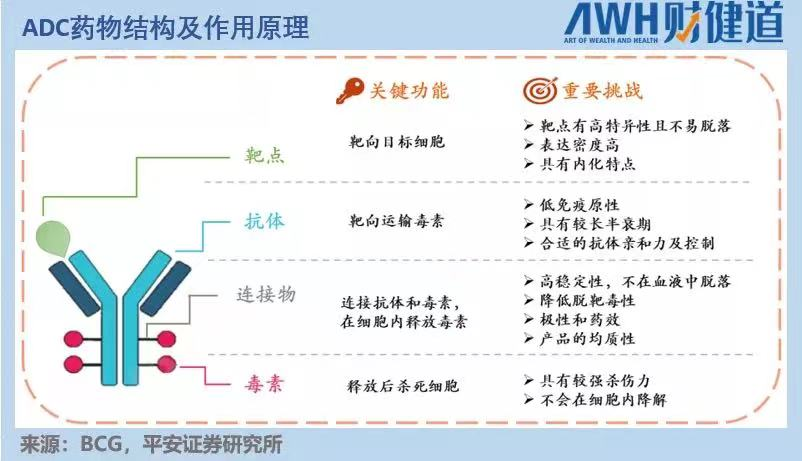
ADC药物的属性就是更高更强,T-DXd又在前任ADC药物基础上做了改良和升级。
复旦大学附属肿瘤医院余科达教授在解读该研究提到,同样作为靶向HER2的ADC类药物T-DXd,是由人源化抗HER2 IgG1单克隆抗体、四肽可裂解连接子、拓扑异构酶I抑制剂(DXd)有效载荷等主要三部分构成。相较于“初代”ADC,“新生代”ADC药物T-DXd具有更高的药物抗体比(DAR:4.5 vs 8),连接子具有可裂解性,具有抗肿瘤“旁观者效应”等优势。
据蒋锐所说,目前T-DXd在临床中大多数时候作为后线疗法,且仍能发挥效果。因为T-DXd携带的化疗药物更多,能够起到更强的杀伤肿瘤的作用,因此能够突破前线疗法的天花板。
不过,在DESTINY-Breast系列研究中T-DXd已经确立了二线治疗地位,蒋锐认为,新药都是从后线做起,经后线证实有效的药物往往都会往前推,T-DXd的前移也是有可能的。
T-DXd的有效性已经被反复验证,但安全性方面令专家们有些担忧。
在DESTINY-Breast 04临床试验中,间质性肺病(ILD)/肺炎发生率为12.1%,大多数(10%)主要是低级(1级或2级)事件,报告5次3级事件(1.3%),未报告4级事件,报告3次5级(0.8%)事件。
美中爱瑞肿瘤医院乳腺科主任潘永表示:虽然DESTINY-Breast 04中,T-DXd取得了很好的疗效,但间质性肺炎的副作用需要我们特别注意。既往的经验是,如果患者在服用过程中,副作用表现是1-2级,但有确切、良好的疗效,我们MDT后,会考虑减量或在激素保护下继续使用T-DXd。如果患者的表现在3级以上,出现了严重的间质性的肺炎,而且疗效不佳时,我们则会停药,用大剂量的激素把副作用尽快控制,为后续治疗做准备。但这样一来,要耽误一个多月的治疗时间,对于这种晚期病人来讲,这一个月可能非常关键。
总的来说,从上述试验数据来看,严重的间质性肺炎发生率较低,大多数情况尚处于可控范围内。
对于癌症晚期患者来说,在考虑副作用之前,先吃上更要紧。
T-DXd已在美国、日本、欧盟、中国香港等国家和地区获批上市。虽然尚未在中国内地上市,但已经在2022年5月纳入CDE优先审评,获批指日可待。
得益于国家的先行先试创新政策,T-DXd已经于2022年2月落地海南博鳌,患者可以在海南博鳌超级医院、瑞金海南医院、博鳌恒大国际医院、博鳌国际医院等医院申请使用。据悉,整个申请流程需要两个月左右。
难住患者的可能是价格。T-DXd在国内的价格,从2020年的20万/周期(21天),降价到6万/周期,常人依然难以承受。
幸运的是,T-DXd共准入了7个省市的惠民保和8个海外特药目录。以上海的沪惠保为例,以下适应症患者可申请T-DXd的赔付:既往化疗后不可切除或复发性HER2阳性乳腺癌(仅限于标准治疗难治或对其不耐受的患者)、癌症化疗后进展的不可切除的晚期或复发性HER2阳性胃癌。非既往症患者可享受70%赔付,对于既往症患者也可享受30%赔付比例,大大降低了患者的治疗经济压力。
02、珠玉在前,国产ADC还有机会吗
截止目前,我国已获批准使用的ADC类药物有三种,分别是以HER2为靶点的恩美曲妥珠单抗、维迪西妥单抗和以CD30为靶点的维布妥昔单抗。
随着T-DXd不断获得新进展,恩美曲妥珠单抗、维迪西妥单抗首当其冲。
荣昌生物(09995.HK)的维迪西妥单抗俨然成为T-DXd的国产平替。蒋锐说:“如果患者到了不得不用ADC药物的地步,但用不起T-DXd时,我们会推荐患者用荣昌生物的ADC,售价1.5万左右/周期,价格相差四倍。”
恩美曲妥珠单抗也在T-DXd在国内申报前降价,降幅超过50%,接近了医保谈判的平均降价幅度。这不难理解,就目前的趋势来看,T-DXd很可能布局恩美曲妥珠单抗所有的适应症,试图全方位的压制。
根据中信证券研报数据,截至2021年底,国内在研HER2 ADC便多达22款。且大部分在研ADC药物多是以恩美曲妥珠单抗为蓝本,目标是成为恩美曲妥珠单抗的me too或me better产品。
但之前的天花板已经被打破,当恩美曲妥珠单抗尚且处于被动地位时,后来者的压力自然更大。
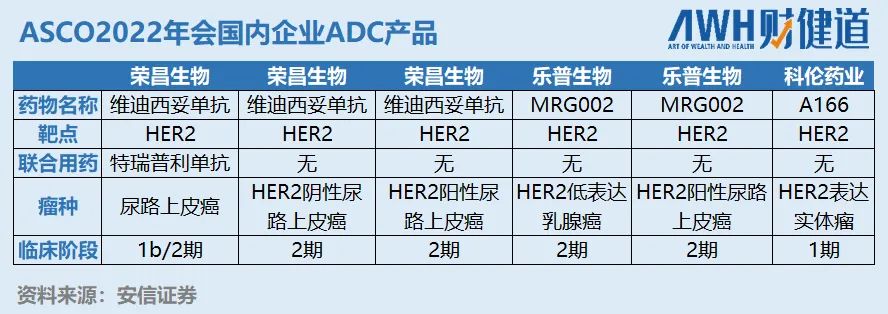
从本次ASCO年会国内企业报道的ADC产品来看,都聚焦在HER2领域,参与的企业有荣昌生物、乐普生物(2157.HK)、科伦药业(002422.SZ)等,主要报道的瘤种为尿路上皮癌与乳腺癌。
在浩悦资本资深合伙人李逸石看来,和T-DXd狭路相逢的国产ADC,想要突破重围,最好的选择是寻找新的创新点。否则,做出一款me-worse,靠更低的价格、更小适应症上市的话,很可能无利可图。
其实ADC的差异性开发存在诸多可能性。不同于单抗药物,ADC药物研发涉及抗体、毒性分子、链接子三部分,三项组合不同,链接方式差异都可能导致疗效和安全性产生巨大影响,另外适应症范围的差异,新技术的应用等都为后来者提供了创新的机会。
蒋锐提出T-DXd在安全性方面还有提升的空间,在肿瘤晚期的时候,病人的身体条件都非常差,所以副作用能不能耐受也是很重要的,很多时候一款药赢就赢在安全性上面。
潘永提出,新兴靶点Trop-2的ADC药物也很有价值。“Trop-2靶点在胃癌、胰腺癌、结肠癌、肺癌、乳腺癌、子宫癌、卵巢癌等多种恶性肿瘤也会处于高表达状态。如果这些肿瘤患者既往治疗无效,Trop-2也将是一个很有前途的发力点。吉利德研发的靶向Trop-2 ADC sacituzumab在三阴性乳腺癌(TNBC)和尿路上皮癌治疗中均取得了不错的成绩。其他癌肿的临床试验也在进行中,我们期待更多好的数据出现,为肿瘤病人提供更多选择。”
据《财健道》不完全统计,目前国内有产品进入临床阶段的国产ADC药物企业共13家。虽然竞争激烈,但李逸石认为,不会出现和PD-1赛道那样的行业内卷。
对PD-1来说,靶点的选择仅仅只是决定研发成功与否的关键因素之一。发现靶点之后的流程,比如进行抗体筛选、序列设计和优化,在如今的抗体行业已经有比较成熟的流程和体系,因此众多药企能够一拥而上。而ADC药物在靶点选择上以经典靶点为主,更关键的是抗体的优化(包括亲和力、内吞效应等)、毒素的选择(包括毒性、半衰期、疏水和透膜性等)、连接子的选择(包括血液中的稳定性和肿瘤组织附近的特异性断裂等),每个环节都有需要克服的技术难点。更不用说从生产工艺来看,ADC药物比抗体难很多,考验的是药企的系统能力。“就凭这两点ADC药物不会那么容易卷起来,更说明拥有底层创新和系统能力的药企不容易受到内卷的影响。”李逸石说。
跨国药企“泰山压顶式”的冲击,提醒ADC药物的研发目标不是及格,而是冲顶;ADC药物特性导致的差异化竞争方式,要求ADC药物的研发方式不是模仿,而是创新。
创新是少数人的事情。如果做不到创新,和百奥泰一样提前退出竞争也无可厚非,它们在发现难以突破重围时终止研发和试验,能够避免临床研发和市场风险,将资源集中在一些真正能够实现创新的领域。正如T-DXd带给国产药企的警示一样,掌声会送给真正的创新。
(作者系《财经》研究员,文中蒋锐为化名)




评论