文|动脉新医药
医药产业的发展总是呈螺旋上升的状态。在近两年被生物药侵占了大量的注意力的当下,小分子药物需要一些新的技术手段助推,以迎来新的产业高潮。以PROTAC、分子胶为代表的蛋白降解技术在此时适时的出现,不仅掀起了小分子药物的新风潮,同时也想外延伸到了更广泛的制药领域中。
基于此,蛋壳研究院撰写了《靶向蛋白降解:小分子药物的下一个黄金时代》,并将在报告中着重回答以下几个问题:
1、小分子降解剂领域为何在近几年得到复兴?
2、关键技术点的发展成熟度如何?
3、有哪些国内外的企业已经准备好了在这个领域中大展拳脚?

4、哪些先头产品在这波浪潮中占据了先机?
5、资本该如何保持清醒的头脑判断产业的未来发展?
为了弄清上述问题,蛋壳研究院在产业内进行了广泛的调研,并结合自己的研究内容,试图从行业概述、技术路径、发展机遇与挑战、未来趋势研判等维度全面解析蛋白降解领域,以期为行业关注者及参与者提供有价值的行业信息。
01 行业概述:小分子药物的下一个黄金时代
靶向蛋白降解是小分子药物的最前沿突破。生物医药从大分子创新药(单抗、双抗、ADC等)、细胞治疗(CAR-T等)、核酸药物、基因治疗、小分子蛋白降解一路走来,新的成药机制不断浮现。技术平台的革新使得新的药物有望克服原有成药机制的瓶颈,也不断延伸出新的挑战,最终创造出具有优异临床疗效的新药。
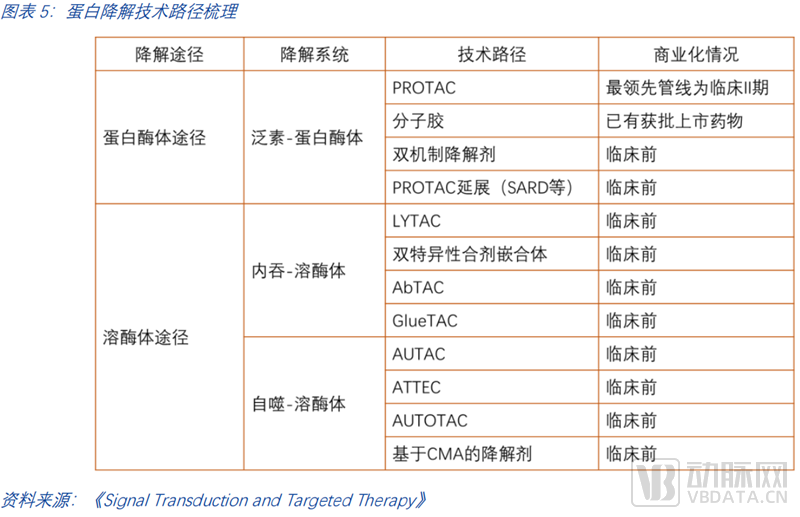
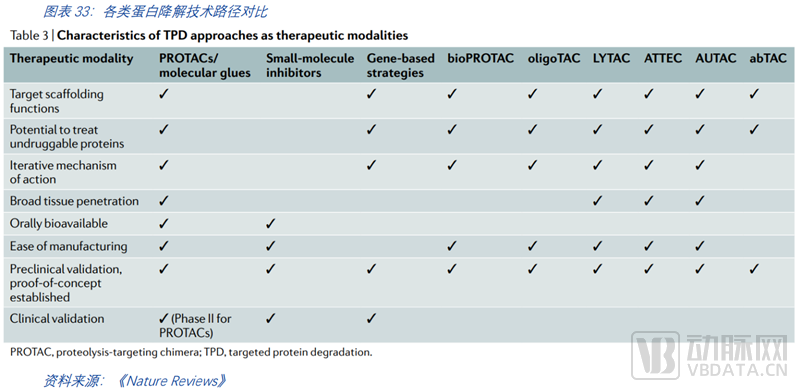
蛋白靶向降解利用人体内天然存在的两大蛋白降解系统:蛋白酶体系统和溶酶体系统实现对致病蛋白的高效精准降解。基于这两大蛋白降解系统,现有多种技术路径开展相关研究并进入临床,最为人所熟知的是PROTAC和分子胶。
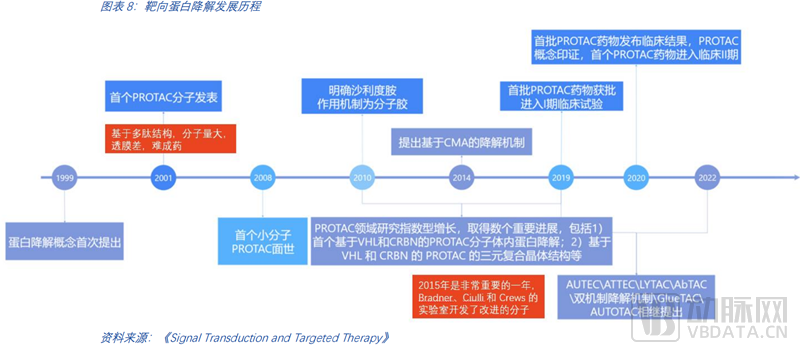
如今,PROTAC已从科研过度到理性设计,进入后概念验证时代。其他技术路径尚处于前期探索阶段。以PROTAC为代表的小分子蛋白降解发展历程已有超过20年的时间。蛋白降解概念的首次提出始于1999年,随后在2015年的早期临床前工作开发了改进的分子,这是里程式的重要进展。2019年开启了首个临床试验。
02 行业优势:理想的抗癌药成药方式
蛋白降解赛道中,随着基础研究和临床试验的不断推进,PROTAC已表现出极大的商业价值。PROTAC有三大优势,一是有望克服耐药,二是有望将“不可成药”变为“成药”,三是有望成为“同类最佳”,是理想的抗癌药成药方式。PROTAC在世界各地被广泛探索,这些降解剂潜在适应症分布广泛,在对抗癌症疾病中表现出色,在对抗免疫性疾病、病毒感染和神经退行性疾病中也有所表现。
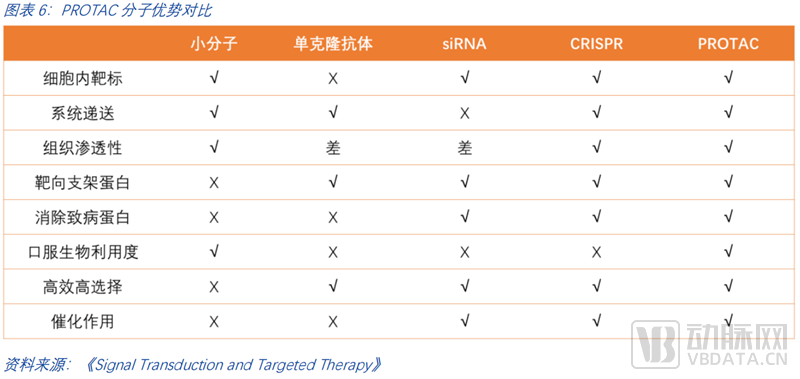
除了以上三大最显著的优势外,PROTAC横向对比其他药物类型,如单抗、核酸药物、DNA药物等,也有显著的综合优越性。一是PROTAC利用蛋白酶体系统从而降解细胞内靶标,而单克隆抗体则难以靶向细胞内的靶标; 二是PROTAC可系统递送,RNA药物的递送仍然存在问题;三是PROTAC有一定的组织渗透性;四是它能够靶向支架蛋白,从而对肿瘤的转移等抑制效果更好;五是它能够清除致病蛋白,传统的小分子药物仅能够抑制蛋白质的活性;六是PROTAC可口服,潜在提升了病人的依从度和药物的可及性,降低了用药的痛苦;七是PROTAC具备高效选择性。PROTAC的泛素化反应需要靶蛋白与E3连接酶保持稳定,这提高了对蛋白的精准选择。例如,多激酶抑制剂Foretinib,可对100余种激酶具有较强的抑制活性(选择性差),而基于Foretinib的PROTAC分子可结合54种激酶(选择性有所提高),但最终仅降解<15种激酶(选择性大幅提高)。潜在的高选择性降低了药物的毒副作用,患者的耐受力将大幅提升。八是PROATC具备一定的催化作用,其PROTAC分子可反复循环使用,这意味着小剂量即有潜力实现较好的降解效果,降低潜在由药物剂量累积导致的毒副作用。
03 行业挑战:三联构象成药难度重重
PROTAC也同样存在待解决的挑战。首先是药代和药效未明。由于PROTAC以催化模式发挥作用,传统方法无法准确评估PROTAC的药代动力学(PK)和药效学(PD)特性。尽管PROTAC有大量的体外和啮齿动物PK数据可用,但更高的物种和人类PK数据非常稀缺。因此,需要更多的研究,尤其是构建更高等的动物实验数据库,来建立PROTACs的PK和PD评价体系,从而以致构建更好的口服体内预测模型。进入人体后,与任何外源分子一样,PROTACs第一个挑战是穿过细胞膜。PROTAC的分子量和氢键供体及受体的数量往往比抑制剂的高,多出来的这部分可以理解为来自连接子和配体。渗透入细胞需要与流出做竞争(这也是许多大分子的常见问题),因此分子特性和细胞渗透也是一个重要的研究领域。虽然有穿越细胞膜的第一重挑战,但许多PROTAC分子能够进入细胞并达到足够浓度,从而有效地达成预期的活动和功能。
PROTAC有三个组成部分,目标蛋白配体、连接子和E3配体。而三联体成药性差,分子量大,透膜性差,并不能很好的符合类药五个原则。高效的三联体筛选方法也存在缺失。三联体的三个部分每个部分的变化互相排列组合,就成为了PROTAC库,具备所有组合的可能性。
E3配体、蛋白配体和连接子的变体越多,PROTAC的合成就越困难。这在实践中是一项巨大的工程。经过10多年的积累,科学界和工业界已经开发出数千种PROTAC分子。2020年,浙江大学侯廷军教授课题组建立了首个线上PROTACs数据库(PROTAC-DB)。截至2021年4月,该数据库包含200多个靶点,共有2258个PROTACs,275个蛋白配体,68个E3配体和1099个连接子。相比之下,现有E3数量极少,在临床中使用的E3更少(仅有VHL和CRBN)。人体中有超过600种E3,如何拓宽E3在PROTAC设计中的应用也是需要进一步探索的课题。
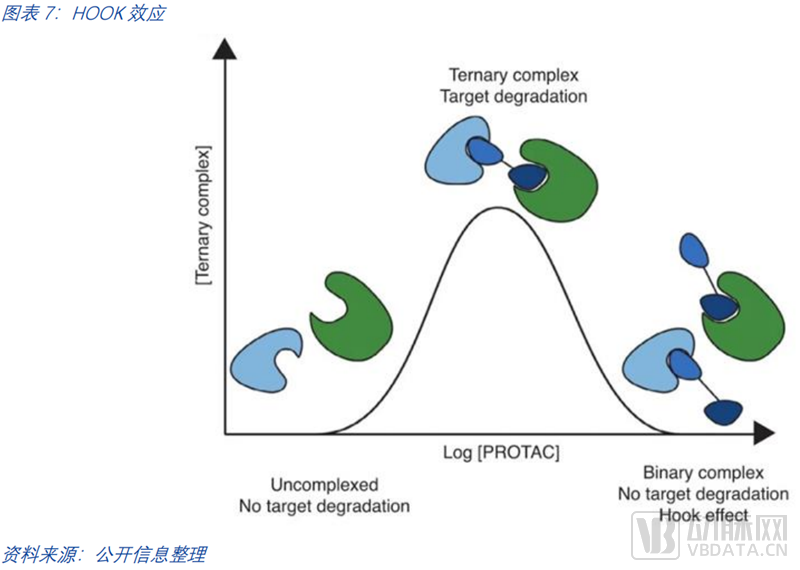
PROTAC的挑战除了其分子自身,在降解过程中也有许多需要实践探知的细节。尽管PROTAC领域取得了许多关键进展,但降解过程、降解靶向性、脱靶效应的理解仍不算全面。在降解过程中,三元复合体的形成也存在困难,PROTAC分子浓度较高时会产生HOOK效应,PROTACs会同靶蛋白和E3酶分别形成复合物,而无法与靶蛋白和E3酶一起形成三元复合物。
04 技术梳理:E3连接酶配体是PROTACs的关键
构建PROTAC的三要素分别为E3配体,连接子和蛋白配体。
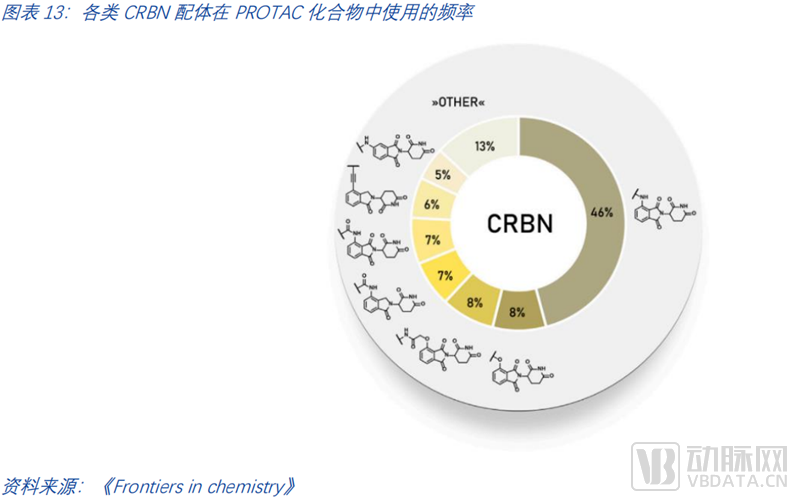
E3连接酶配体是PROTACs最关键的构成部分。大多数PROTAC仍然使用CRBN或VHL作为E3连接酶。CRBN配体常用的有三类。一是基于泊马度胺的配体,二是基于4-羟基酞胺的配体,三是基于来那度胺的配体。由PROTAC-DB数据统计,截至2021年PROTAC化合物中使用的各种CRBN配体频率如下图所示。
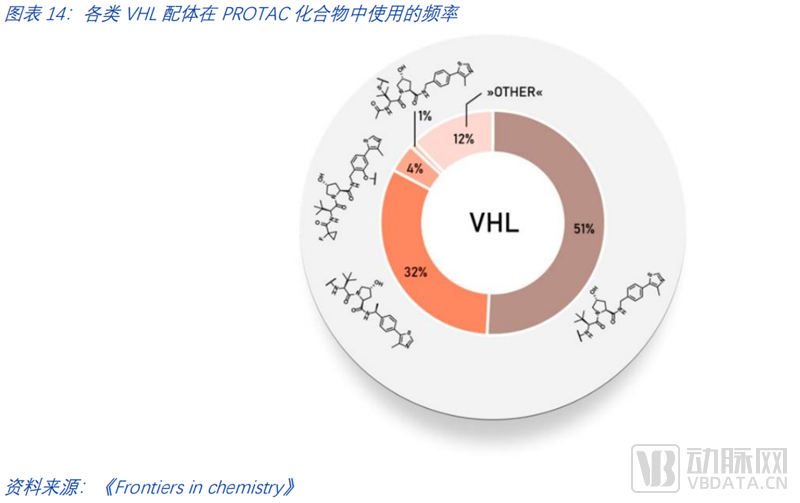
由PROTAC-DB数据统计,截至2021年,PROTAC化合物中使用的各种VHL配体的频率如下图所示。
蛋白配体在PROTAC分子中用于结合目标蛋白。该配体需要与目标蛋白有一定亲和力,因此现在多数配体采用了目标蛋白的小分子抑制剂。特别的是,配体对目标蛋白的亲和力要求并不高,结合力较弱的PROTACs仍可以对目标蛋白有较高的降解效率。
连接子的功能是连接E3配体和目标蛋白配体。连接子的设计会影响到E3:PROTAC:目标蛋白的稳定性,从而影响目标蛋白的降解效率。常用的连接子有PEG等。连接子的长度、连接子与配体的结合位点以及连接子的化学结构等对PROTAC降解效率有所影响。通过结构生物学和计算研究可以帮助更合理的设计PROTAC,但连接子的设计、合成目前缺乏指导设计的理论依据。对连接子的构建仍任务繁重。
05 行业格局:近半国内企业18年前后进入赛道
国内约有20余家企业开发布局PROTAC,近半国内企业18年前后进入赛道。海创药业是PROTAC赛道上的代表企业并于近期上市。海外有众多企业布局PROTAC,Arvinas、C4、Kymera是处于第一梯队的代表性企业,均已上市。
从国内布局PROTAC的公司分布可以发现,大多中小企业成立于2017-2018年,这也是PROTAC领域研究指数级增长的年份。随后即2019年,第一款PROTAC药物ARV-110进入了临床。如今,国内的大药企也逐渐着手布局PROTAC技术,百济神州、恒瑞医药等皆有布局PROTAC赛道。海外有诸多中小企业专注或重点布局在PROTAC赛道,现已有多家上市企业。近十家大型药企如拜耳等前后布局PROTAC赛道。
如何评价一家蛋白降解公司?靶向蛋白降解赛道上的公司旗下最领先的临床管线在临床I/II期(参考后文管线全览),现阶段各个公司的策略不尽相同,体现在科学风险和商业风险的考量。科学风险上,回顾蛋白降解的“事件驱动”,需要一个特定的化合物去泛素化标记目标蛋白,这涉及到三点:一是通路和靶点的选择(有充分验证或者不充分的甚至全新的),这意味着风险的不同;二是基于选定靶点下技术路径的选择,各技术路径的技术成熟度差异分化大,需要考量基础研究的进展(论文、专利等等);三是既定技术路线下的公司人才储备,像蛋白降解几个成药难点,涉及到对E3的理解,连接子的构建等等,有没有相关的技术平台能够系统化的完成筛选合成,团队的执行力和资源配置等等。商业风险上,适应症是什么,是否作为末线治疗方案,对商业价值会有很大的影响。
蛋壳研究院简要盘点了蛋白降解领域的头部公司,尽管靶点选择、路径选择皆有不同,但基本都拥有自己的药物开发平台,可系统性的筛选和合成化合物,且平台的立足重点是E3连接酶。
Arvinas是蛋白降解领域当之无愧的领头者。Arvinas成立于2013年,创始人是PROTAC的概念提出者耶鲁大学Craig M. Crews教授。目前布局的靶点较保守,两款首批进入临床的药物其靶点(雌激素受体ER和雄激素受体AR),均已有高程度的验证。Arvinas通过与其他公司合作研发药物管线。Arvinas已同数家药企巨头达成合作,如辉瑞、基因泰克、默沙东等。
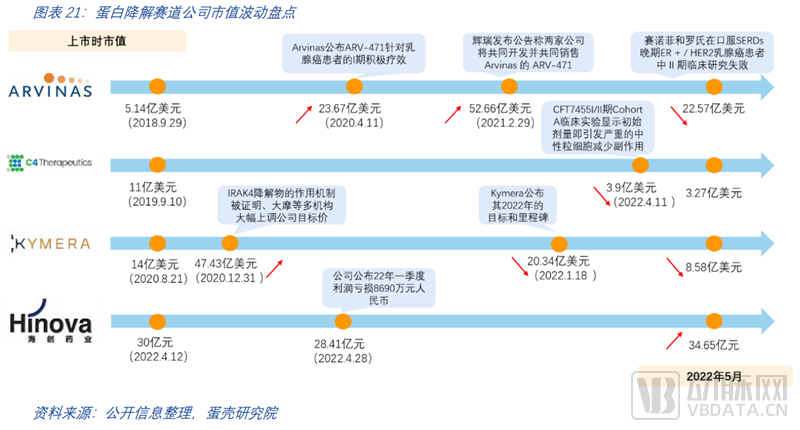
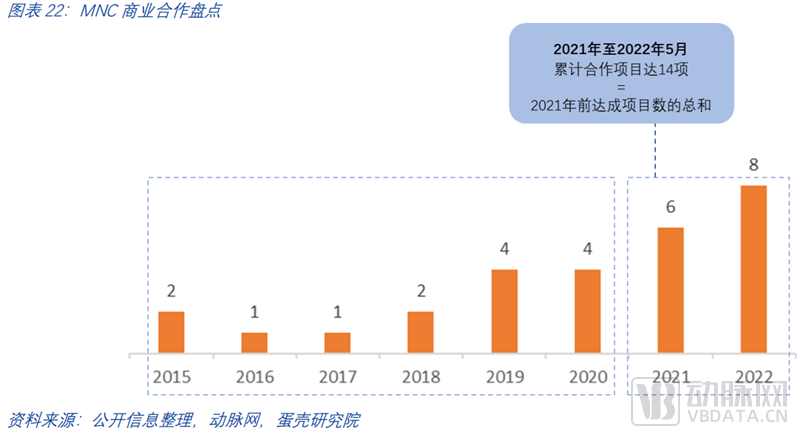
截止至2022年5月,各大国际药企与头部TPD公司已经达成多个上亿美元级别合作项目,合作的深度和费用体量都体现了大药企对此赛道的持续看好。跨国大药企(MNC)们在蛋白降解领域的布局早在2015年就已经开始,但赛道的火热起始自2021年。
2021年至今MNC在蛋白降解赛道达成的合作项目达14项,是2021年前达成项目数的总和。仅过去一年,合作项目披露金额超60亿美金,合作数量平均每月一项。药企投资合作的标的也从赛道中的几家代表性头部企业扩张到更多有特色专研于细分方向的初创企业。
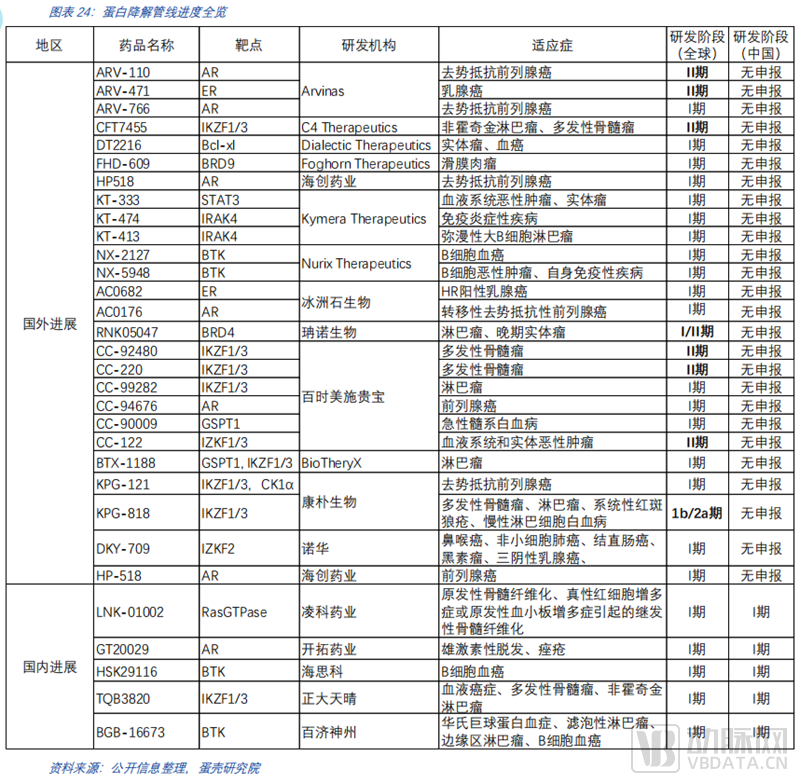
截至2022年5月不完全统计,全球共有临床阶段蛋白降解药物约31个。从进入临床的靶标来看,集中度很高。靶点的选择上多在有临床验证的靶点,策略较为稳健。管线布局研发方式中,以创新药公司自研为主,大药企合作为主的方式布局。
06 技术趋势:从定义更适合降解的靶点出发
靶向蛋白降解未来20年将会如何发展?PROTAC概念的提出者Craig Crews给出了四个方向。一是定义和阐释临床上最合适降解的靶点类型,二是扩大E3连接酶的图谱以实现精准治疗,三是延展肿瘤以外的疾病治疗;四是临床验证分子胶和PROTAC以外的蛋白降解方式。
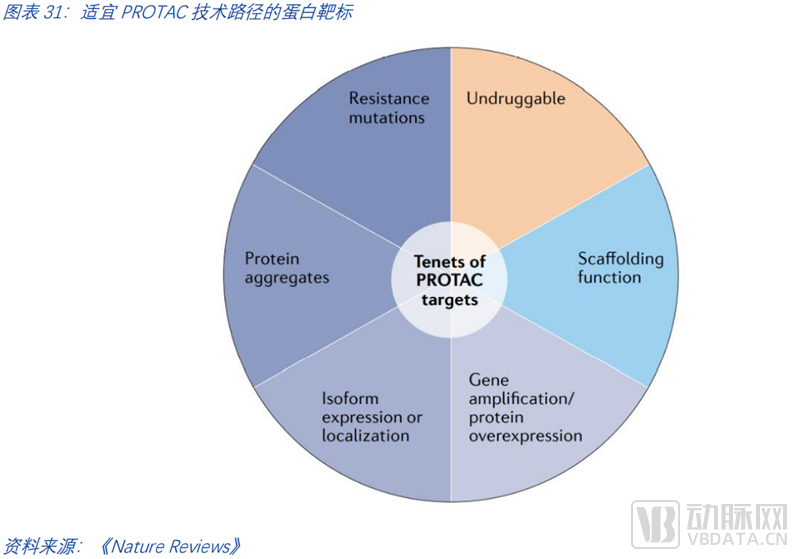
找到最合适的靶点们。合适PROTAC的靶点画像具备的特征可以分为四类。第一类特征是“不可成药”。如前文所述,第一波降解剂的浪潮是那些经典的可成药靶点,在临床中已有充分验证。这些靶点的“PROTAC化”很好的验证了PROTAC模式的有效性,和潜在的优越性(从现在的让蛋白降解和此前的仅是抑制蛋白功能)。而最具前景的未来是在于那些现有技术路径难以成药的靶点。第二类特征蛋白表达偏离自然状态,如过度表达、突变、聚集、异构体表达等等。第三类特征是支架蛋白。第四类特征是该靶点对现有疗法已产生了耐药性。
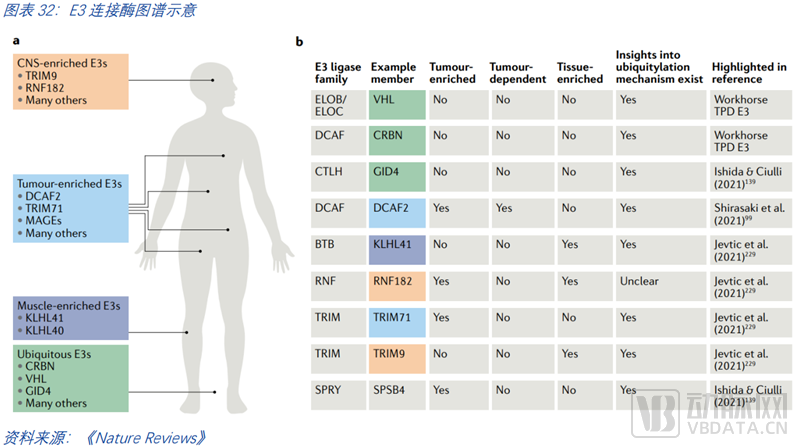
扩大E3连接酶的图谱。扩增可用的E3连接酶是必然发展的趋势,人体有超过600种E3连接酶,而在临床上使用的仅2种(CRBN和VHL),常用的仅五六种。新的E3出现是一个何时出现,而非会不会出现的问题。从特异性的角度来说,E3连接酶也可以分为几类。一是应用广泛的连接酶,然而降解效率却有所不同,基于连接酶的结构特征,可以找到更适用于PROTAC的连接酶。二是特异性的连接酶,许多连接酶有组织和细胞特异性,其在肿瘤中或许富集、或许必不可少,如能找到此类连接酶,则有望实现对肿瘤的精准治疗。三是高富集的连接酶,此类连接酶的优势在于肿瘤细胞难以通过连接酶的突变从而对PROTAC分子药物产生耐药性。但这种方式临床是否真的有效仍需验证。
延展肿瘤以外的疾病治疗。适应症发展方向可以分为三类,首先是炎症免疫方向,二是神经疾病和神经退行性疾病方向,三是抗病毒方向。前文(4.2适应症分布)已罗列了各个发展方向的前沿进展,随着研究和临床的推进,更多适合以蛋白降解方式成药治疗的适应症将浮出水面。
拓展蛋白降解模式。尽管PROTACs有望成为某些具备特定特征蛋白降解的重要方式,但有些蛋白并不具备这种方法所需的小分子结合位点。即便如此,这些目标仍然可以被其他的类PROTAC方法降解,包括生物PROTACs和混合PROTACs。还有其他类别的异功能分子值得探索,这些分子利用溶酶体而非泛素-蛋白酶体机制来降解目标蛋白,其中每一种都有不同于其他TPD模式和小分子抑制剂的特点。以PROTAC和分子胶为代表的泛素-蛋白酶体途径主要作用于胞内蛋白,因此膜蛋白及分泌蛋白的降解仍需要更进一步的探索和临床验证。
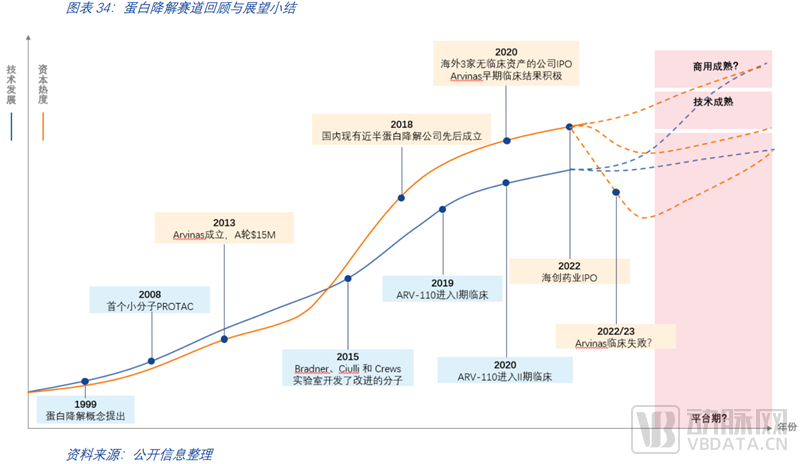
07 资本趋势:22/23年的临床至关重要
2015年以前,靶向蛋白降解并不为人所熟知,资本的参与也极弱。2015年改进的分子发布后,人们对蛋白降解的关注度迅速提升。无论是科研端还是产业端,都积聚了许多的资源投入在这个领域,许多蛋白降解公司如雨后春笋般快速崛起。回顾国内公司的布局情况,现有近半的优秀的小分子创新药公司都是在2018年前后成立的。2020年,海外三家公司(C4、Kymera、Nurix)收获了IPO,那时候这三家公司还均没有临床资产。2022年,国内的蛋白降解第一股海创药业迎来了IPO。自2015年至今,蛋白领域的资本热度已快于技术进展,这也为蛋白降解领域孵化了更多的优秀公司,助力更多的前沿技术更快推进。第一款药物ARV-110正处于II期临床中,可以预见的是,未来蛋白降解领域的发展将很大程度取决于首批药物的临床结果。无论走向如何,可以确定的是任何一个领域的巨大成功和它背后的颠覆式技术离不开多年的研究积累和无数的波折失败。
同时,小分子的配套产业链已非常成熟,参与者少,竞争格局较好,相比其他创新药领域高生产难度和白热化竞争,蛋白降解的发展会更快更好。有时尽管细分的技术路径不一定短期内取得巨大的进展,但过程中积累的Know-how将厚积薄发,爆发出惊人的力量。
过去的20年蛋白降解模式不断沉淀积累孕育了巨大的疾病治疗潜力,文末,让我们一起期待蛋白降解的未来20年。




评论