文|氨基财经 林晓晨
5月13日,一家名叫Caribou的公司突然成为行业内关注的焦点。
原因是,其“通用型”CAR-T疗法CB-010在治疗复发/难治性B细胞非霍奇金淋巴瘤患者的1期临床试验中,获得100%总缓解率(ORR)的惊人疗效,让Caribou一跃成为“通用型”CAR-T疗法的希望之星。
然而,这份喜悦仅仅维持了一个月,在6月10日公布的后续随访数据中,此前接受Caribou“通用型”CAR-T疗法的6名患者中,有3名在治疗后的6个月内出现癌症复发的情况。
这让Caribou“通用型”CAR-T疗法的前景受到质疑,其股价更是在随访数据公布后的两个交易日中暴跌41.5%。Allogene、CRISPR Therapeutics、Precision Biosciences 等同样聚焦“通用型”CAR-T疗法的公司也受到牵连,股价也在最近两个交易日出现连续暴跌。
究竟为何疗效出色的明星产品会出现如此大的落差呢?这又是否会成为“通用型”CAR-T疗法的滑铁卢?
复发率50%?情况并没有那么糟糕
既然Caribou在公布6个月随访数据后,引发了市场对于“通用型”CAR-T疗法的质疑,那么我们就必须从这份数据开始复盘,从而找到数据背后的意义。
根据Caribou披露的数据,共有6名患者参与CB-010的试验。在给药初期,这些患者的症状均有所缓解,ORR达100%,完全缓解率(CR)达83.3%(n=5/6)。

然而,从第3个月开始,逐渐有患者出现癌症复发的情况,到第6个月,又有两名接受治疗的患者出现癌症复发。因此,尽管初期ORR 100%,但CB-010最终却收获了50%的癌症复发率这样一个让人失望的数据。
不过,透过现象看本质,这50%的复发率真得客观吗?或许未必。
在Caribou进行的整个1期ANTLER试验中,不仅存在样本容量小,仅有6名患者的问题,而且这6名患者还分散在滤泡性淋巴瘤(FL)、套细胞淋巴瘤(MCL)、弥漫性大B细胞淋巴瘤(DLBCL)以及原发性纵隔大B细胞淋巴瘤(PMBCL)这四大适应症中。
这样的数据意味着,Caribou的这次1期试验,追求的就是CB-010对各适应症的初期反应,并未对不同适应症进行差异化设计。
基于这样的背景,实际癌症复发率这项数据的意义并不大,并不能算作CB-010的失败,相反其不俗的缓解率和极低的副作用,反而证明CB-010有望应用于这四大适应症中。
全球经济环境趋紧的背景下,市场因CB-010数据而抛售是可以理解的,但如若将这次初级试验归结为“通用型”CAR-T疗法的滑铁卢,将“通用型”CAR-T疗法的未来彻底抹杀,那是有失公允的。
究竟是何原因导致了失败?
凡事皆有因果,尽管我们认同CB-010的机会,但同时也无法忽略1期试验高复发率的事实,抛开各种客观因素不谈,究竟是何原因导致了CB-010的失败呢?
经过系统分析,我们认为在缓解率极为优秀的情况下,CB-010出现如此高复发率的原因可能有两方面:剂量和设计。
一直以来,副作用始终是阻碍CAR-T疗法发展的主要原因之一。无论是自体CAR-T疗法还是“通用型”CAR-T疗法,副作用都是FDA和药企最先考虑的因素。
在Caribou之前,“通用型”CAR-T疗法的“老师傅”Cellectis公司和Allogene公司就都曾因副作用问题,而被FDA暂停临床试验;自体CAR-T疗法方面,Juno的明星疗法JCAR015也是因安全问题而被迫终止。
对于“通用型”CAR-T疗法而言,其细胞本就是来自于体外,如果操作不慎,很容易引发机体排异反应,因此为了保障试验的安全性,Caribou仅采用了4000万个CAR-T细胞的保守剂量。
很多朋友可能对4000万个细胞的剂量没有太多概念,这么说吧,人类第一次“通用型”CAR-T疗法被应用于一个名叫蕾拉的“白天”婴儿身上,而当时的剂量则是5000万个细胞单位,Caribou所用的剂量甚至比人类最初的应用还要低20%。
较低的给药剂量很有可能是CB-010的1期试验中,患者后续癌症复发的原因所在。
除了给药浓度,CB-010还可能存在CAR细胞设计上的缺陷。因为在设计上,Caribou并没有在规避宿主自体免疫反应方面,给出一个完美的解决方案。
作为市场中第一款敲除PD-1基因的“通用型”CAR-T疗法,它降低了抗肿瘤免疫,进一步增强了CAR-T细胞的抗肿瘤活性,能够更有效的减少肿瘤的体积。
然而,CB-010虽敲除了PD-1基因,但在避免移植物抗宿主反应方面,似乎其做得并不够好。
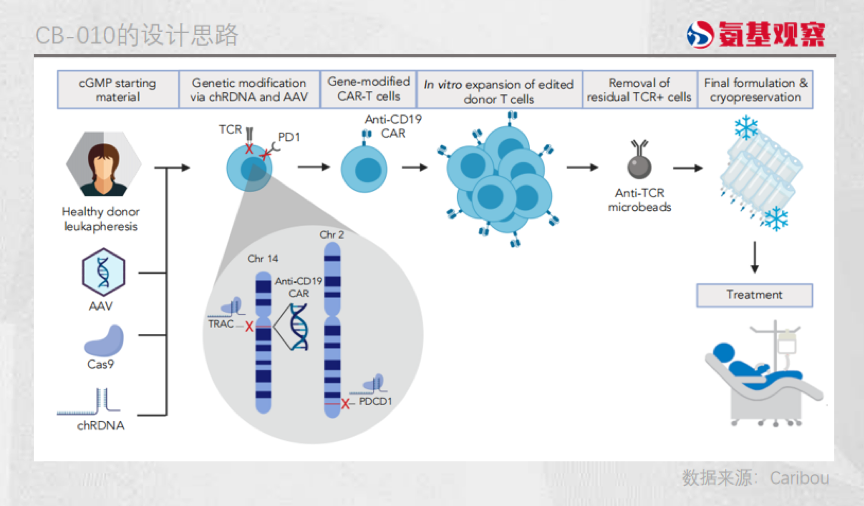
由于CAR-T疗法通过抗体识别肿瘤,并不需要TCR基因进行识别,因此行业中往往采用敲除TCR的方法来降低CAR-T细胞由TCR带来的影响,CB-010也选择了这一做法。但在另一关键基因MHC1上,CB-010却并未采用特殊的方法进行处理。
从理论上看,由于CAR-T细胞中存在MHC1基因,导致它很容易被患者体内的T细胞攻击,导致浓度降低从而失去抑制肿瘤的能力;另一方面,如果敲除掉MHC1这个基因,CAR-T细胞又会遭遇NK细胞的攻击,同样可能无法发挥好的效果。
实际上,“通用型”CAR-T疗法对于MHC1基因的处理是十分值得探讨的,目前这块的研究也并不充分。CB-010选择保留MHC1基因,这样做可以减少使用CRISPR工具所造成的脱靶风险,但同时也可能是造成癌症复发的原因所在。
尽管我们在这里分析了这么多,但CB-010的疗效依然需要后续的试验进行验证。
如果CB-010的癌症复发仅仅因为剂量不足,那么增加对照试验找到合适的剂量即可,但如果CB-010最终是因为基因设计的缺陷,那么Caribou就只能回炉重造了。
对于创新应该多一些包容
目前,仅仅因为早期的数据就对CB-010给出失败的定义,这样的做法并不客观。实际上,在Caribou公司看来,近期公布的数据不仅不是坏消息,反而坚定了其后续试验的信心。
Caribou在4000万个CAR-T细胞浓度下,就实现了初期ORR达100%,且到目前为止,整个临床试验的安全性也是很不错的。
整个试验周期中,仅有疫苗患者出现短期的3级免疫效应细胞相关神经毒性综合征(CRS),并在39个小时内消退,此外就只有两名患者患有1级的CRS。
放眼未来,Caribou即将开始招募第二剂量水平的患者,也就是给药量从4000万提升至8000万,希望通过增加剂量的方式,推动药效更加持久,而届时的数据才更有代表性。
但几乎在CB-010披露高复发率数据的同时,诺华的传统CAR-T疗法Kymriah也公布了长期随访数据。
具体来看,Kymriah疗法5年总生存率(OS)为55%(95% CI:43-66),而5年无事件生存率(EFS)则为42%(95% CI:29-54)。试验长期追踪结果显示有82%(95% CI:72-90)的病患出现缓解。
两相对比,CB-010的悲观情绪被进一步放大,甚至有不少投资者认为,“通用型”CAR-T疗法永远不会取代自体CAR-T疗法。
尽管CB-010存在失败的可能,但哪一次的创新不是建立在失败的基础上呢?对于勇于创新的产品而言,实则我们应该给予它们更多的包容。
例如如今疗效稳定的自体CAR-T技术,也是经历过数次迭代才产生的最终样子,如果没有之前的数次努力,或许就不会有如今的CAR-T技术。
30年前,第一代CAR-T技术诞生,然而它是一种基于CD3-ζ链的 CAR-T 细胞,虽然该 CAR-T 细胞具有激活 T 细胞的特点,但却不包含共刺激分子,这导致其在体内的持续扩增有限,不具备大规模杀灭肿瘤细胞的能力。而后,业界不断完善CAR-T细胞,才有了如今成熟的CAR-T疗法。
聚焦当下,抑制CAR-T疗法发展的不是疗效,而是效率。动辄上百万的医药费用,导致这种疗法无法走入大众之中,降低价格乃是大势所趋。
此种背景下,“通用型”CAR-T疗法省掉从患者身体提取T细胞的过程,不仅能让整个CAR-T细胞培育过程大幅缩短,甚至可以让企业根据患者的情况,提前规划CAR-T细胞的产能,从而形成规模效应降低成本。
降低成本,是CAR-T疗法未来发展的必经之路,而“通用型”CAR-T疗法是目前行业内最佳的选择方案。
且不论Caribou的CB-010尚有成功的机会,就算CB-010真的因癌症复发率而失败,那么它也是一次对于创新的很好尝试,并且具备进一步产品迭代的可能。或许市场是最敏感的,但它却并不总是对的,对于创新企业而言,需要行业内更多的包容与肯定。



评论