文|氨基财经
玻尿酸、肉毒素,完美切中无数爱美人士的需求,商业化效果深得人心,华熙生物、爱美客也由此占据医美领域绝对的C位。
但要说今年最火的医美成分,却是一个老成分,胶原蛋白。
大家都知道,胶原蛋白与细胞衰老息息相关,其在皮肤组织中含量高达70%,不仅联合弹力纤维支撑着皮肤的基本结构,也对皮肤的水润、弹性和质地起到关键作用。因此,它有着皮肤软黄金之称。
比起玻尿酸,胶原蛋白的发现与应用要早上20年,但因为安全性、量产种种问题,被玻尿酸反超。以2009年双美生物的胶原蛋白填充剂进入中国市场为起点,胶原蛋白在国内市场已走过10余年,却一直不温不火。
直到今年,以巨子生物、锦波生物、创尔生物、敷尔佳为代表的公司接连冲击上市,胶原蛋白又被推到风口上。就连玻尿酸巨头华熙生物,也重点布局了胶原蛋白。
那么,早几十年的胶原蛋白为何一直没能爆发?如今的重组胶原蛋白又能否让其复刻玻尿酸的成功。
蹉跎几十载,依旧小众的胶原蛋白
胶原(collagen)源于古希腊,最早出现于1865年前后。
胶原蛋白的研究历史则可以追溯到1940年。有文献报道称,采用柠檬酸缓冲液,可将胶原蛋白从大鼠皮肤中溶解释放出来。在医疗领域的应用,是整个胶原蛋白产业的发端。
1976年,美国将胶原制品列入医疗器械进行管理。这一年前后,医诺美(2006年被艾尔建收购)将牛胶原用于改善老年性皱纹的临床试验开始。
1981年,医诺美的牛胶原蛋白植入物Zyderm Ⅰ获FDA批准。这是全球第一款被FDA批准上市的胶原蛋白植入剂,揭开了短效填充的序幕。
比起玻尿酸产品的获批,胶原蛋白早了20年,但其商业化之路,却要艰难得多。
从海外市场来看,领先玻尿酸20年的胶原蛋白,也曾有过好时光。Zyderm Ⅰ上市两年后,Zyderm Ⅱ也于1983年成功上市。Zyderm Ⅰ和Zyderm Ⅱ分别含有3.5%、6.5%的牛胶原,并分别适用于浅表和中层皮肤的相关美容修复。
2000年左右,胶原蛋白占据软组织填充剂市场约90%份额。但早期牛胶原产品致敏率高,且疯牛病传播下产品安全性面临考验,叠加2003年玻尿酸产品获批后对胶原形成替代,胶原蛋白市场逐渐萎缩。
如今,医美填充市场已是玻尿酸的天下。
国内市场也是如此。根据华创证券测算,国内胶原蛋白注射市场规模约为10亿元,仅占我国注射级医美超300亿元市场的3%左右。
不难看出,相比玻尿酸,胶原市场一直属于小众产品。自2009年第一款胶原蛋白填充剂肤柔美进入中国市场,到2018年这10年间,双美生物胶原蛋白年销售额(出厂口径)不超过7000万元。而仅2018年,华熙生物的营收就超过12亿元,其中仅玻尿酸原料便贡献近50%。
但比起玻尿酸,胶原蛋白不仅问世早,由于其特殊分子结构,应用范围广泛。

如上图所示,三螺旋构象是胶原蛋白理化特性和生物学活性的基础,使其具备高拉伸强度、生物降解性能、低抗原活性、低刺激性、低细胞毒性等优势。除了注射的医美产品,胶原蛋白向下扩展到食品领域,向上进军医疗领域。
如今的玻尿酸,还在努力向其看齐。除了常出现在手术场景中的医药级别玻尿酸注射液,还有“玻尿酸原液”、“安瓶”等化妆品。去年,华熙生物还推出了玻尿酸饮用水,进军食品领域。
这一发展路径,几乎与胶原蛋白无异。看到这里,你可能会有疑问,既然如此,为何过去这么多年来,胶原蛋白一直不温不火?
原因无他,要将一种生物成分大规模应用在医疗/医美消费领域,安全性、量产、成本等各方面因素都需要综合考虑。而量产、成本等供给端的限制,极大限制了胶原蛋白的商业化。
胶原蛋白量产还在路上
时间回到80多年前,彼时的玻尿酸还被封存在未知而神秘的领域中。直到哥伦比亚大学的眼科教授首次从牛眼玻璃体中分离出这种物质,才打开潘多拉的盒子。
由于提取过程复杂,人类对玻尿酸的研究与应用,又经历了缓慢发展的几十年。
根源在于,动物组织提取法原料来源有限、分离纯化工艺复杂、产品质量低、生产成本高、产能有限且污染环境,致使玻尿酸量产受限。上世纪70年代,受限于技术,200多公斤鸡冠才可提取一公斤透明质酸,当时医用级透明质酸价格高达10万美元/kg。
直到80年代,日本用微生物发酵法成功生产玻尿酸,成本大幅降低。
国内玻尿酸行业的突破也起步于这一时期,山东省药科院实现了生物技术生产透明质酸钠及药物制剂的科技攻关,并实现了玻尿酸的量产。到2018年,华熙生物注射级透明质酸原料销售价格为11.38万元/kg,根据毛利率还原得到注射级原料生产成本约1.02万元/kg。
这是玻尿酸在医美市场大放异彩的关键。从天然提取到逐渐摸清高产率表达条件,最终实现量产,并广泛运用到医美消费领域。
但时隔这么多年,胶原蛋白的量产还在路上。
从制备方法来看,全球范围内,由于具备工艺成熟、提取制备的胶原活性强等优势,动物组织胶原提取技术仍为主流胶原制备技术。
所谓动物组织胶原提取,是指通过对鱼、鸟、牛、猪等动物组织去杂质、溶解、分离提纯,然后提取胶原蛋白。这样获得的胶原能保持完整的三螺旋结构,生物活性较强,但有可能携带可传播的疾病,同时也可能产生异种或异体排斥反应。
目前看,这一制备技术的难点,在于如何降低动物源性材料的病毒风险、提高纯度、降低成本。根据华创证券,奥精医疗牛胶原采购成本为14万元/kg,而双美注射针剂生产成本则高达 200万元/kg,远远高于玻尿酸成本。
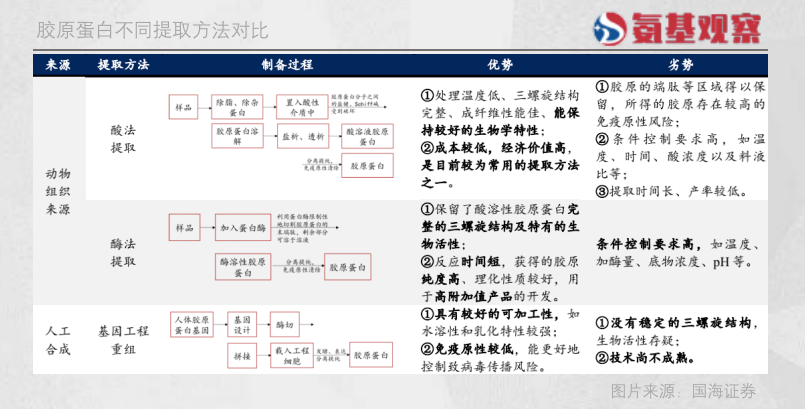
近年来,以巨子生物、锦波生物为代表的国内公司,将基因工程技术用于制备重组胶原。也就是通过基因的酶切、拼接和表达获得重组胶原蛋白。这种制备方法也是胶原蛋白未来生产的趋势。
不过,这样得来的重组胶原蛋白有较强的水溶性和乳化特性,且免疫原性较低、能更好控制病毒传播风险,但由于没有稳定的三螺旋结构,生物活性仍存疑,胶原支撑性也不够。
不难看出,这一制备技术的难点在于,如何保持胶原独特螺旋结构、实现大规模量产降低成本。按照华创证券测算,每克人源胶原蛋白材料售价在1万元以上,按照锦波生物90%毛利率计算则生产成本在100万元/kg。
实际上,早在上世纪80年代,美国的医学博士Uitto J从人体皮肤细胞体外培养中得到Ⅰ型和Ⅲ型胶原蛋白。
此后,国外研究者试图通过昆虫细胞、酵母菌等媒介合成与人体相似的重组胶原蛋白。但通过生物学方式合成培养的问题在于成本高、时间周期长,导致重组胶原蛋白长期困于实验室,无法产业化应用。
某种程度上,直到现在,胶原蛋白的量产路径仍较模糊,如何提纯、大规模稳定地生产,将产量放大至公斤级甚至吨级,还是待解之谜。
胶原蛋白能否复制玻尿酸传奇
除了原料规模化生产尚未取得突破,分子结构差异导致胶原人工合成壁垒更高,交联技术尚不成熟、成本高效期却短,这些也是困扰胶原蛋白更进一步的难题。
先来看分子结构问题。玻尿酸是由双糖单元重复连接而成的一种高分子线性多糖,结构相对简单,更易提取合成,目前业内对大分子量的发酵也已较为成熟。
而胶原蛋白分子结构复杂,需要三条肽链去形成三股螺旋的结构,这导致细菌发酵过程中存在一些难点,比如肽链长(需连接1000多个氨基酸),还要保持三股螺旋缠绕结构(完整的三螺旋结构才能发挥胶原理化特性、生物活性)等等。
现有部分储备技术虽然已能形成胶原蛋白的三螺旋结构,但仅能生产部分肽链片段,还不能形成完整肽链。
如果说,分子结构复杂问题会限制重组胶原的生产及应用,那么交联技术则会限制胶原蛋白的商业化结果,因为成本高、效期短,对于终端消费者而言,性价比太低。
由于玻尿酸和胶原蛋白注入体内后,都容易被降解,为了增强稳定性、延长吸收代谢时间,交联成为普遍的技术手段。
在这方面,玻尿酸的技术同样比较成熟,而胶原蛋白还存在交联剂残留易出现细胞毒性、交联度差、储存不稳定、破坏三螺旋结构等问题,采用酶促反应进行胶原交联则成本过于昂贵。
尽管如此,市场仍认为胶原蛋白有潜力成为玻尿酸之后的第二大爆款。
经过十多年的市场教育,大众对胶原蛋白概念较为熟悉,胶原蛋白作为“老”材料正迎来“新”应用。
从需求端看,胶原蛋白正中爱美者痛点,比如其具备美白、改善肤质等效果,能满足求美者从单一的填充塑形需求发展为美白、抗衰、紧致等多元需求。
2019年以来,胶原蛋白于眼周、泪沟等精细化部位的优势也逐渐被挖掘。尤其,重组胶原蛋白技术在避免了原本免疫原性的缺点后,从食品到医美再到医疗三个不同的场景下,都有不错的产品出现。典型如这几年大火的医用敷料(医美面膜)。
不过,医用敷料市场门槛较低,竞争激烈。相较而言,医美注射领域壁垒更高。如下图所示,与玻尿酸相比,胶原蛋白填充剂优势在于填充效果与促使再生,劣势在于时效与定价。

更重要的是,胶原蛋白竞争格局优于玻尿酸。
目前,获批的胶原蛋白注射类医疗器械只有6种,包括双美(肤柔美、肤丽美、肤力原)、荷兰汉福生物(爱贝芙)、长春博泰(弗缦)、锦波生物(薇旖美),其中薇旖美是首个重组胶原蛋白注射针剂。而玻尿酸则多达40余种,竞争激烈。
随着玻尿酸巨头们在二级市场的股价迈过最高点,怀着对“下一个玻尿酸”的渴望,市场也开始押注胶原蛋白。
风口下,敷尔佳、创尔生物、巨子生物、锦波生物先后IPO。其中,巨子生物IPO前估值就已接近200亿元,获得高瓴、君联、鼎晖等一众知名机构的青睐。
但需要注意的是,无论是在量产技术突破,还是市场整体需求层面,现阶段的重组胶原蛋白与玻尿酸仍存在一定差距,不过差距也意味着机会。
技术迭代、市场需求、资本追逐,能否改变潮水方向,让胶原蛋白复制玻尿酸的传奇?我们继续看下去。



评论