文|氨基财经
对于创新药来说,最高殿堂无疑是First in Class(FIC)。
FIC意为首创新药,它是第一个能够治疗某种疾病的全新机制药物。这需要进行大量的基础研究工作,整个过程需要花费的时间,远远超过你的想象。
当然,难度与收益成正比。一般情况下,药品上市顺序对市占率大小起关键作用。麦肯锡研究报告指出,FIC类药品平均获得45%左右的市占率。
也正因此,在Fast Follow落幕之后,国内创新药企纷纷表示,要“扛起”FIC大旗。
不过,凡事都有例外,FIC并不意味着性能“完美”,通常来说依然有极大的改进空间,由此有了Me better、Best in class药物诞生的基础。
Me better偏向于性能比原研药存在一定优势;Best in class则是在所有同类药物中,战斗力最强的那一个。
可以说,在竞争激烈的市场,FIC产品并不保险。一旦自身数据跟不上,而后来者又展现“超车”可能,FIC产品无疑会压力山大。
眼下,安进去年刚刚获批上市的FIC产品KRAS G12C抑制剂Lumakras,已经开始遭遇挑战。
/ 01 /三期临床数据成功背后的隐忧:未能延长患者生存期
去年5月28日,安进的KRAS G12C抑制剂Lumakras获FDA加速批准上市。这是全球首款获批上市的KRAS靶点药物,市场为之躁动不已。
可以理解。作为人类历史上第一个被发现的致癌基因,RAS基因突变与约20%的肿瘤有关,但一直难以成药,被列为著名的“不可成药”靶点。
随着安进摘得圣杯,KRAS靶点不可成药一说被彻底打破,必然值得振奋。
不过,Lumakras之所以能够率先突围,某种程度上与KRAS突变患者存在着未被满足的临床需求有关。
通常来说,一款药物需要经过严格的三期临床,才能获批上市。但因为存在巨大的临床未满足需求,FDA仅是基于Lumakras I/II期临床试验CodeBreaK 100的结果,便加速批准其上市。
加速批准并非一劳永逸。Lumakras在上市之后,还需要经过通过临床三期数据,获得真正意义上的“批准”。
在9月份的2022年ESMO大会上,安进便公布了Lumakras治疗经治非小细胞肺癌患者的3期临床试验CodeBreak 200的最新结果。
看起来,CodeBreak 200结果较为积极,达到了无进展生存期的主要终点:
与标准化疗相比,Lumakras显著提高患者的无进展生存率。在接受治疗1年后,Lumakras组的无进展生存率为25%,化疗组这一数值为10%。
不过,次要终点总生存期方面,Lumakras治疗组并不乐观,只有10.6个月;而对照组多西他赛治疗组患者的中位总生存期为11.3个月。
这也意味着,Lumakras治疗组挣了面子,输了里子。对于肿瘤患者来说,接受肿瘤药物治疗的根本目的是延长生存期,但Lumakras无法实现之一目标,数据看上去还不如化疗组。
不过,对于这组数据安进并不认可。安进认为,这一试验的设计并没有足够的样本数来发现OS方面的统计区别,并且进展后交叉用药也掩盖了Lumakras的临床获益情况。
但目前来看,Lumakras的未来依然会充满变数。
一方面,Lumakras的月治疗费用高达1.8万美元,而多西他赛的月治疗费用不过2000美元。虽然多西他赛需要静脉注射使用,而Lumakras口服即可拥有给药便捷度更高的优势,但面对巨大的价格差距,显然会让Lumakras的销售面临压力。
另一方面,全球KRAS G12C抑制剂在研产品众多,国内就涌入了再鼎医药、加科思、益方生物、劲方生物、勤浩生物、贝达药业、君实生物、艾力斯等药企。一旦后来者拿出更好的临床数据,无疑会挑战Lumakras这款FIC产品的地位。
实际上,在结直肠癌领域,Lumakras便已经遭受挑战。
/ 02 /结直肠癌:联合疗法遭遇挑战
KRAS G12C抑制剂的研发,适应症扩充必不可少。
就全球范围来看,KRAS基因突变主要存在于非小细胞肺癌、结直肠癌和胰腺癌中,占比分别为25%、40%、95%。
Lumakras虽然在非小细胞肺癌领域占得先机,但在其它癌种的研发领域并没有显著优势,目前来看在结直肠癌适应症领域就遭受挑战。
在KRAS G12C抑制剂的竞争中,Lumakras最大的竞争来自Mirati公司的Adagrasib。目前, Adagrasib肺癌适应症已经递交上市申请。
在此次ESMO大会上,两家公司均公布了KRAS G12C抑制剂联合EGFR单抗治疗结直肠癌的早期数据。
安进公布的名为Codebreak-101 subprotocol H 的数据显示,Lumakras联用帕尼单抗的 ORR(客观缓解率)为30%,较单药疗效大幅提升(ORR为9.7%)。
不过,Adagrasib看上去战斗力更强。Mirati公布的名为Krystal-1的研究显示,Adagrasib单药和联合疗法ORR分别达到了19%和46%。
考虑到Adagrasib试验中的患者在之前尝试过三线治疗,而Lumakras的研究只有两线治疗,Mirati的结果似乎更好。
Mirati公司之外,另一挑战者是罗氏。罗氏公布的数据显示,其KRAS G12C抑制剂GDC-6036 在剂量爬坡临床中,取得了单药20%的ORR,后续数据显然值得关注。
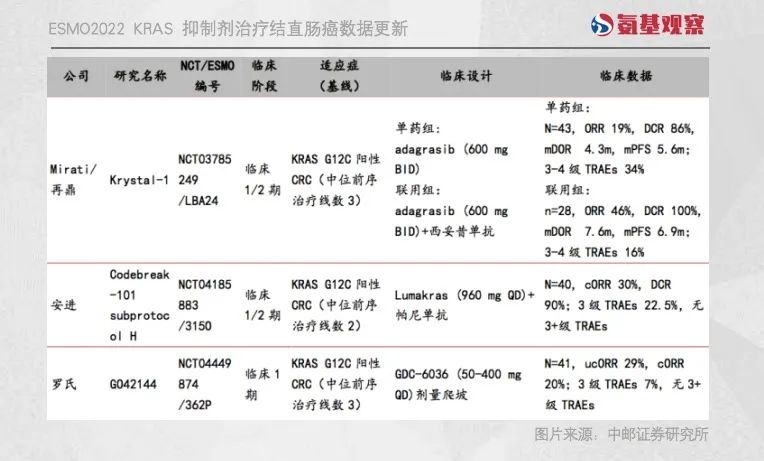
当然,三家公司在结直肠癌领域公布的都为早期临床数据,后续能否保持当前优势还需要时间才能给出答案。
但不管怎么说,Lumakras作为FIC产品的优势,并没有那么稳固。
/ 03 /为竞争对手敞开大门,“FIC”产品也有压力
作为全球首款KRAS G12C抑制剂,安进的Lumakras无疑自带明星光环。Lumakras的面世,也引发了KRAS G12C抑制剂的研发热潮。
不过,如今Lumakras的光环似乎日渐黯淡。实际上,这在其销售数据层面早已体现。
2022年第一季度,Lumakras在美国的销售额达到了4800万美元;但第二季度该产品在美国销售额仅5100万美元,环比增速不到7%,与第一季度27%的环比增幅相比大幅放缓。
事实上,SVB证券分析师认为,如果不是7月1日该产品美国价格上涨3%,Lumakras的销售额可能会更低,因为涨价会促使一些批发商在6月份提前购买。
也正因此,SVB 指出Lumakras的表现远低于市场预期。基于此,SVB分析师还将Lumakras的全年销售额预期下调至3.26亿美元,而此前华尔街的预测为3.47亿美元。
Lumakras在二季度就开始展现颓势并不令人意外。虽然Lumakras打响了KRAS G12C抑制剂的第一枪,但数据并不完美。
当时,在为期两年的随访分析中,174名患者的客观缓解率为40.7%,相比此前虽有所提高,但依然不算是“天花板”;而在安全性方面,20%以上的三级副作用某种程度上也限制了Lumakras的使用。
此前,SVB分析师认为,后续临床数据的读出,将成为Lumakras能否站稳脚跟的关键。
如今,随着最新“拉垮”三期临床数据的披露,势必会进一步引发市场的担忧。正如上文所说,后来者如过江之鲫涌入KRAS G12C市场,Lumakras势必会遭遇后来者挑战。
虽然无论是成就还是市场, First-in-class产品对药企和投资者都有相当吸引力。但最终,还要回归到产品本身的价值。



评论