记者|张乔遇
过去5年,在抗肿瘤药物研发领域中,细胞治疗逐渐成为热点研发方向。截至2022年4月,全球共计有2756项免疫细胞治疗正处于不同临床阶段(含研究者发起的临床试验)的研发,较之2021年同期增长约36%,其中美国、中国的研发数量居于前两位,分别达到791项、695项。
近日,一家专注于突破性免疫细胞治疗产品研发与生产的创新生物医药公司——上海恒润达生物科技股份有限公司(简称:恒润达生)向上交所科创板递交了招股书,中金公司为保荐机构。
由于无上市产品,目前恒润达生无主营业务收入,进展最快的产品预计2023年提交NDA申请。2019年至2022年1-3月(报告期),公司扣非后归母净利润累计-5.70亿元,截至报告期末,恒润达生累计未分配利润为-2.76亿元。
总经理年薪三百万
恒润达生前身达生有限成立于2015年7月20日,由李国顺、上海寓庸、李国清、上海觉海和恒润研究所共同出资500万元设立。

本次发行前,恒润达生实控人李国顺通过直接、间接持股和一致行动关系合计控制公司49.18%的股份。
此外,国有股东张江火炬、新时代资本分别持有公司总股本的1.35%、0.70%;深创投持有公司0.90%的股份,杭州红土(持股2.93%)、红土医疗(持股1.35%)、金山红土(持股0.90%)、威海红土(持股0.45%)的基金管理人,执行事务合伙人也均为深创投控制的主体,合计持有公司5.63%的股份。
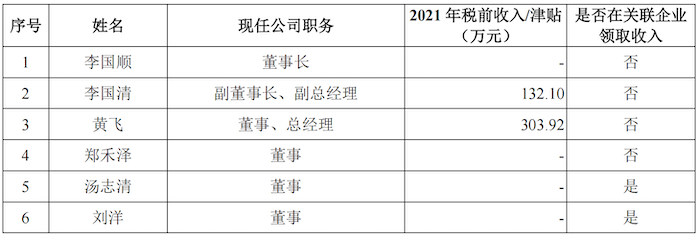
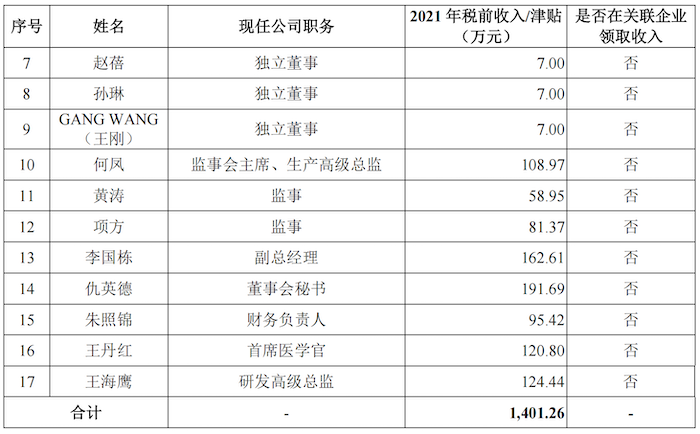
界面新闻记者注意到,恒润达生董事、总经理黄飞2021年税前收入高达303.92万元,黄飞2015年7月加入公司,现任恒润达生董事、总经理。除在关联企业领取收入外,公司董事长李国顺及郑禾泽均未披露薪酬情况。
恒润达生本次预计募集资金25.39亿元,其中13.37亿元用于肿瘤免疫细胞治疗产品的研发项目;6.03亿元用于总部及产业化基地(一期)项目;还有6.00亿元用于补充流动资金。
据悉,占募投项目比例较大的总部及产业化基地(一期)项目拟选址上海张江创新药产业基地,但截至招股书签署日,恒润达生尚未取得募投项目用地的国有土地使用权,已进入用地项目产业准入审批程序,上述项目在后续的投资进度可能受到取得土地使用权证的进度影响,从而造成募集资金投资项目的实施风险。
已有同类药物上市
2015年至2021年,全球肿瘤免疫治疗市场的复合增长率为53.01%,肿瘤免疫治疗市场规模从2015年的26亿美元增长至2021年的335亿美元,预计到2030年将增长至1890亿美元。2021年,中国的肿瘤免疫治疗市场为267亿人民币,预计到2030年,将超过2000亿人民币。

恒润达生是一家专注于突破性免疫细胞治疗产品研发与生产的创新生物医药公司,主要聚焦恶性血液病和实体肿瘤领域的细胞治疗产品。以自主研发的CAR-T细胞治疗产品为先导,同步布局CAT-NK等产品开发管线。
灼识咨询数据显示,截至2022年4月,全球共有2756项免疫细胞治疗正处于不同研发阶段(含非注册临床试验),较之2021年同期增长约36%。其中,CAR-T、NK&NKT(包含CAR-NK)细胞治疗更是研发热门方向,且作为研究作为广泛、发展最为成熟的细分领域,CAR-T细胞治疗在临床前和临床的各个阶段均有大量的管线在推进。
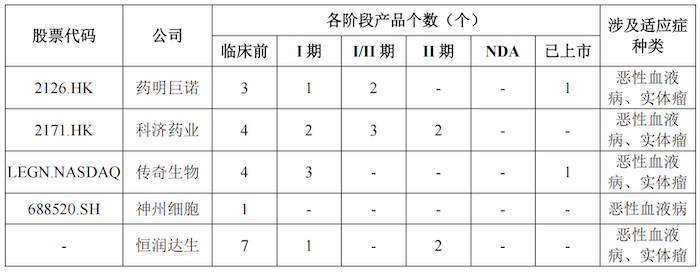
2017年,全球首款CAR-T细胞治疗产品获批上市,2021年,中国首款CAR-T细胞治疗产品——复兴凯特的阿基轮赛注射液(奕凯达)也在NMPA获批上市。目前,全球已有8款CAR-T细胞治疗产品获批上市。
其中,国外上市的CAR-T细胞治疗产品包括Kymriah,Yescarta,Tecartus,Breyanzi,Abecma和Carvykti,国内上市的CAR-T细胞治疗产品包括奕凯达以及倍诺达。其中6款产品的靶点为CD19,Abecma和Carvykti的靶点为BCMA。
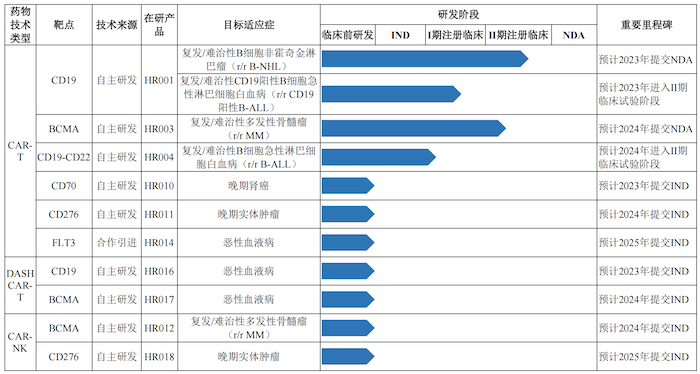
据招股书披露,恒润达生正在开展包括CAR-T、CAR-NK等技术在内的10个主要产品对应的11个在研项目,有4个在研项目尚处于临床试验阶段,尚未实现产品上市销售。报告期,恒润达生的研发费用分别为8436.79万元、8459.53万元、1.60亿元和9964.31万元。
其中,恒润达生进展最快的管线HR001治疗复发/难治性B细胞非霍奇金淋巴瘤(r/r B-NHL)适应症被纳入CDE“优先审评审批程序”,已处于II期注册临床试验阶段,预计于2023年提交NDA。
HR003治疗复发/难治性多发性骨髓瘤(r/r MM)适应症被纳入CDE“突破性治疗药物程序”,已处于II期注册临床试验阶段(确证性临床试验),预计2024年提交NDA申请。
需要指出的是,国内目前已有针对r/r B-NHL的同类药物获批上市销售,已有针对r/r MM的同类药物提交NDA,且有多个同类药物处于不同的临床试验阶段。恒润达生HR001、HR003未来获批上市销售后,不仅面临与上述品种的直接竞争,还将与同适应症的其他药物展开竞争。
天价药遇商业化难题
由于公司暂无产品上市,恒润达生产品尚无营业收入。2019年至2022年1-3月,恒润达生扣非后归母净利润分别为-1.20亿元、-1.17亿元、-2.08亿元和-1.25亿元。截至报告期末,恒润达生累计未分配利润为-2.76亿元。
同期,公司经营活动产生的现金流量净额分别为-8792.16万元、-6340.70万元、-1.66亿元和-8086.82万元。
但烧钱研发的风险背后能为公司带来的收益同样较高。虽然肿瘤免疫细胞治疗产品单次给药后获得长久的临床获益,乃至实现治愈,但因其研发周期长、研发难度大、病毒载体生产成本在其生产成本中占较大比例致使制备成本高等因素,目前全球已获批上市的CAR-T细胞治疗产品价格均较为昂贵。
例如,依据公司年报及灼识咨询数据,Kymriah治疗r/r B-ALL儿童及青少年、r/r DLBCL成人患者、r/r FL成人患者适应症的治疗费用均达到了47.50万美元;Yescarta治疗r/r LBCL成人患者、r/r FL成人患者适应症的治疗费用约为37.30万美元;Breyanzi治疗r/r LBCL成人患者适应症的费用约为41.03万美元。
国内方面,奕凯达治疗r/r LBCL成人患者适应症的治疗费用高达120万元人民币;倍诺达治疗r/r LBCL适应症的治疗费用高达129万元人民币。
如此“天价”对于消费者而言无疑是巨大经济压力。除此之外,CAR-T细胞治疗的流程通常包括从患者身上分离T细胞,对患者T细胞进行改造及体外扩增,最后将CAR-T细胞治疗产品输回患者体内。从患者采血至会输通常需要3-4周,整个过程高度定制化、制备周期长、技术流程复杂、质量控制难度高。
另外,CAR-T细胞治疗产品在冷链物流及医院端管控要求也很高,全流程达到药品监管要求的技术难度大,导致大规模产业化应用面临巨大的技术挑战。因此,如何提升生产规模,降低生产成本成为当前肿瘤免疫细胞治疗亟待解决的挑战之一。
恒润达生表示:公司通过全自主开发的稳转细胞株病毒载体生产系统,实现了病毒的规模化生产,可有效降低包括HR001在单剂CAR-T细胞治疗产品的成本,有望惠及更多患者。但能否真正实现规模化和降低成本,成本降幅多少?目前未有答案。
此外,肿瘤免疫细胞治疗产品应用范围有限,在实体瘤领域疗效不佳,成药性上同样面临挑战。




评论