文|未来迹FutureBeauty 林宇
“械字号”再起波澜!
10月27日,国家药品监督管理局医疗器械标准管理中心对外发布了《2022年第三次医疗器械分类界定结果汇总》(下称《结果汇总》)。据了解,本次发布的文件涵盖了今年7月至9月的医疗器械产品,分类界定结果共388个。
《结果汇总》中,对当下热门医美项目中所广泛使用的医美器械产品做了分类管理建议,超20款医美器械产品的判定界限有所变动,其中最值得关注的是对医用敷料的调整。
01 新增12款医用敷料,被列入II、III类医疗器械管理
医用敷料是一种常见的医疗器械,在医疗卫生领域起着重要的作用,已得到广泛应用。它主要用于清洁覆盖创面、吸收体内渗出液、为创面提供愈合环境,有些医用敷料还可用于手术过程中支撑器官或组织。[1]
经《未来迹Future Beauty》梳理发现,此次被建议纳入II类医疗器械管理的产品共计12款,其中10款为医用敷料产品。其中,经常被用于激光/光子/果酸换肤/微整形手术后护理的“医用海藻糖创面敷料”也在其中。
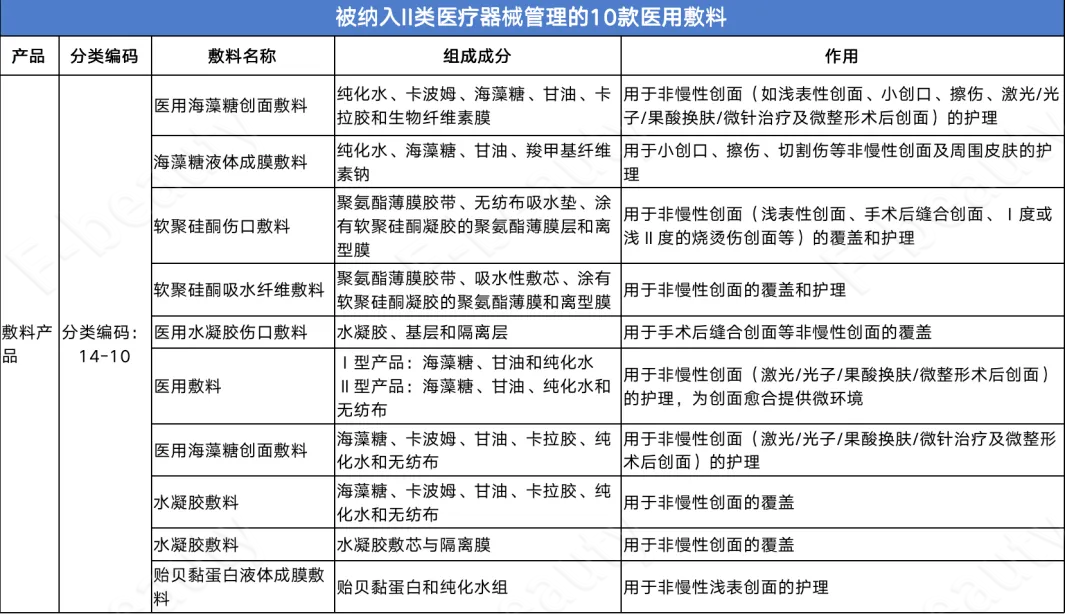
值得注意的是,用于激光、光子术后浅表创面和浅表非慢性创面护理的“医用胶原蛋白敷料”被列入了III类医疗器械管理,但在组成成分中注明了该“胶原蛋白”指的是“动物源性原料”。这意味着,动物源胶原蛋白敷料被正式纳入III类医疗器械管理。当下最热门的利用合成生物技术生产的“重组胶原蛋白医用敷料”是否也会被纳入III类医疗器械管理目前尚不明确。

不过,在此前1-6月份药监局发布的《结果汇总》中,已经将医用重组胶原蛋白可吸收敷料纳入了III类医疗器械的管辖范围中。但其应用范围明确界定为:用于下述疾病及由于创伤导致的全层皮肤缺损:(1)Ⅲ度烧伤、(2)外伤性皮肤缺损、(3)肿瘤或溃疡、胎迹等切除后的皮肤缺损、(4)皮瓣去除部位等。

但目前市面上大量存在的“重组胶原蛋白敷料”主要用于激光、光子术后浅表创面和浅表非慢性创面护理;而与其功能相似的“医用透明质酸钠修复贴”则归于二类医疗器械。
“应该不会以成分进行分类,因为还要考虑到其他的辅料和剂量上的问题。”襄阳杨四郎公司质量负责人柴振丽表示,“并且在法规公布之前,已经注册过的产品有五年的注册有效期,在这期间还可以继续生产销售,到期后才会受到管控。此外,厂家还有一个过渡期,打个比方,产品的注册证书在八月份到期,八月份之前生产的东西还是可以进行售卖。”
按照我国现行的监管制度,在医疗器械的分级中:凡是用于慢性创面(各种原因形成的长期不愈合创面)、体内创面护理、具有润滑防粘连、组织填充支撑等作用的医用敷料,按照第Ⅲ类医疗器械管理;如仅用于皮肤浅表(真皮及以下)小擦伤、浅Ⅱ度烧烫伤,且组分不被人体吸收、不发挥药理学作用,可按照第Ⅱ类医疗器械管理;如果仅用完整皮肤保湿或者具有去痘功能,则不作为医疗器械管理;如果仅通过在创面表面形成保护层,起物理屏障作用(如成膜且不对体表产生刺激)的医用敷料,可作为第Ⅰ类医疗器械管理。[2]
从这个角度来说,仅用于激光、光子术后浅表创面和浅表非慢性创面护理的“医用胶原蛋白敷料”被列入了III类医疗器械管理,显然是被“升级”处理了。
不过,《未来迹Future Beauty》调研发现,动物源胶原蛋白由于存在携带病毒以及产生人体排异等风险的可能,因此世界各国均将动物源胶原蛋白在医疗领域的应用产品列入最高等级风险予以监控,甚至严格限制其进出口。[3]
我国将动物源胶原蛋白医用敷料列入III类医疗器械管理,应该是意料之中的事情。《未来迹Future Beauty》在天猫搜索发现,目前在市面上销售的主流“医用胶原蛋白敷料”,比如巨子生物旗下的可复美、安德普泰旗下的芙清等品牌,均采用的是“重组胶原蛋白”,持有的是二类医疗器械证件;而采用动物源胶原蛋白的创尔生物旗下的创福康,则已经持有的是三类医疗器械证件。
02 “械字号”擦边球被彻底堵死,监管进入“严上加严”时代
不难看出,“安全性”是医疗器械监管的核心指标。
2019年,国家卫生健康委员会官网发布了医疗器械安全管理的行业标准,根据医疗器械风险程度进行了详细划分,分为低风险、中风险和高风险,也就是《医疗器械监督管理条例》(以下简称《管理条例》)中的一类、二类和三类。
其中,一类医疗器械的管理较为宽松,常规控制即可;二类医疗器械则需要特殊控制;三类医疗器械存在较高潜在风险,必须严格控制。
医疗器械和美容化妆品行业的大面积交集出现在“面贴膜”市场。
此前,很多化妆品企业利用一类医疗器械相对宽松的监管,以“医用冷敷贴”的名义申请了大量的一类医疗器械证号,并以“械字号面膜”的名义进行产品宣传和销售。但这股风潮很快被监管部门叫停。
国家药监局先是在2020年初明确提出:“不存在‘械字号面膜’的概念,医疗器械产品也不能以‘面膜’作为其名称。紧接着在2022年初修订的《第一类医疗器械产品目录》中,将医用冷敷贴直接从目录中进行了剔除,并要求相关产品在2022年4月1日前完成备案信息变更。
至此,只剩持有二类和三类医疗器械证号的“医用敷料”,被允许在医美或者微整形后使用。
“II类的申请门槛比I类的要高得多。”襄阳杨四郎公司质量负责人柴振丽告诉《未来迹Future Beauty》,“企业为一个产品申报注册证需要的最短周期也要花费八个月到一年时间,提交申报资料、现场验收、包括最后注册证、生产许可证发放,都需要专业的指导,所以要支出大量的人力、物力和财力,一般的小型企业硬件和软件都达不到要求。”
此外,根据国家发布的相关法规,二、三类医疗器械除了可以明确工作机理、生产工艺成熟,已上市的同品种医疗器械临床应用多年且无严重不良事件记录,不改变常规用途的,以及可以通过其他非临床评价证明该医疗器械安全、有效的,可以免于提交临床评价,而其余情况下的申请应当按规定进行临床试验。

而在实际的监管中,二、三类医疗器械的监管执行单位,也有很大的区别。
根据《管理条例》与《医疗器械注册与备案管理办法》,第一类医疗器械实行产品备案管理,备案人向设区的市级负责药品监督管理的部门提交备案资料即可办理。而二、三类医疗器械需要进行产品注册管理,其中二类医疗器械由省、自治区、直辖市药品监督管理部门进行审查,而三类则由国家药品监督管理局审查,经各自部门批准后才发给医疗器械注册证。

不光在生产和监管环节,在流通环节,二、三类医疗器械的要求也高很多。
《管理条例》规定,从事医疗器械经营活动,应当有与经营规模和经营场所和贮存条件,以及与经营的医疗器械相适应的质量管理制度和质量管理机构或人员。为保证产品安全性和有效性,对运输、贮存、温度、湿度等条件皆有要求。
而实际上,销售一类医疗器械,一般只需要去工商局增加营业范围就可以。但从事二类医疗器械经营的企业,需要向所在地设区的市级相关部门进行备案并提交上述相关资料。而从事三级医疗器械经营的企业不仅要提交相关资料,还需要向市级相关部门申请经营许可,相关部门需要对申请资料进行审查,必要时还会组织核查。从事二、三类医疗器械批发业务及第三类医疗器械零售业务的经营企业,还应当建立销售记录制度,包括产品名称、型号、供货者或购货者名称、地址等信息。

不仅如此,监管部门还不停地在法规方面修补漏洞,对医疗器械的监管正在进入“严上加严”的时代。
柴振丽告诉《未来迹Future Beauty》,在II类医疗器械分类目录中,明确要求所含成分不被人体吸收,不含药理作用。“之前没有强调这句话的时候,有很多厂家打擦边球,为医疗美容领域带来很大的风险。”
而10月31日,国家市场监督管理总局等七部门联合印发的《关于进一步规范明星广告代言活动的指导意见》还规定,明星不得为医疗器械代言。
因“医疗器械”的产品宣称能带给消费者天然的安全感和吸引力,所以在过去,有很多品牌为自己加上“械字号”的标签。“如果想做医疗器械,就乖乖地保证产品安全,把东西给做好。因为III类的规格比较高,普通人是做不了的。” 广州荃智美肤生物科技研究院研发总监张太军表示,“目的在于将一些打‘擦边球’的产品的路给彻底堵死。”
03 秩序重建,部分医用敷料可能会涨价
医用敷料的江湖,越来越用秩序说话了。
《未来迹Future Beauty》观察到,自2017年9月4日,国家药监局正式发布新修订的《医疗器械分类目录》开始,国家药监局每隔一段时间就会对医疗器械产品的分类界定结果进行汇总更新。


梳理发现,自2019年开始,诸多敷料类产品与具备医美功效的注射类产品接连被纳入III类医疗器械管控的范畴。
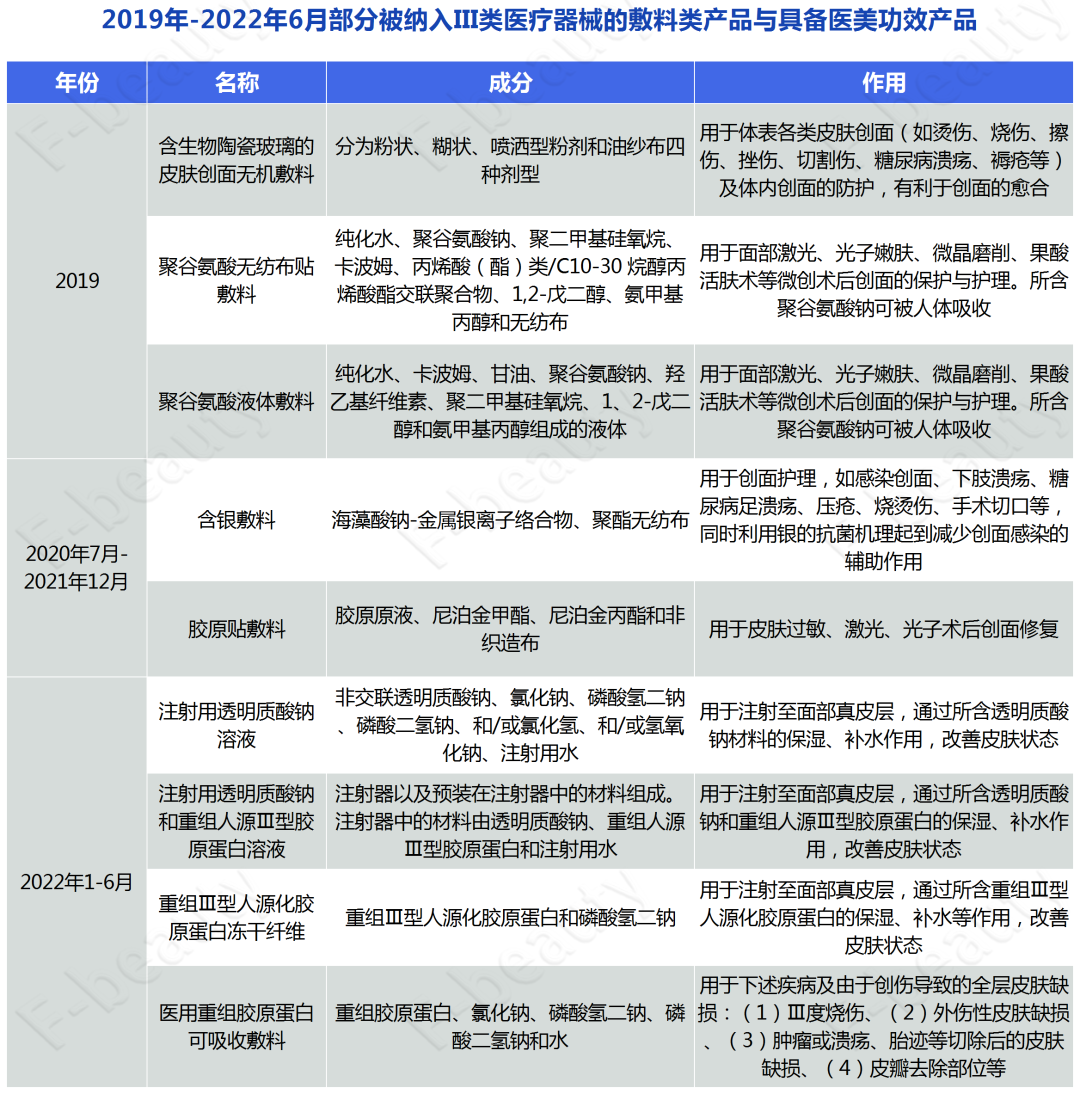
在2020至2021年年底这段时间,国家药监局发布的《结果汇总》中,被新纳入II类医疗器械管理的敷料类产品达25个,这一数量在2022年初截至今年9月,预计又将增加12个。

2020年1月至2021年12月部分医用敷料产品截图
此外,11月14日,药监局也为目前市面上比较火的品类——医用透明质酸钠发布了产品管理类别的《公告》。
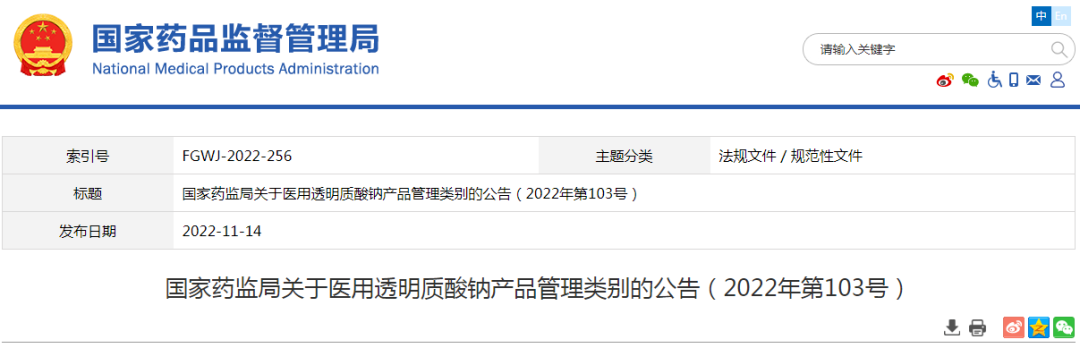
在《公告》中,将根据该类产品的不同用途进行分别管理,但按照医疗器械管理时,管理类别不得低于第二类。例如将医用透明质酸钠作为医用敷料应用时,若产品可部分或者全部被人体吸收,或者用于慢性创面,按照第三类医疗器械管理;若产品不可被人体吸收且用于非慢性创面,按照第二类医疗器械管理。
目前市面上比较火的敷尔佳“白膜”“黑膜”,则被列入第二类医疗器械管理范围。
除了透明质酸钠外,今年4月,药监局也对重组人源化胶原蛋白进行了医疗器械行业标准立项,这也标志着重组人源化胶原蛋白将迎来更具安全性、标准化的管理。

伴随着对医美类医疗器械的管控越发细致与严格,会给原先“挂羊头卖狗肉”的厂家带来巨大的冲击与影响。与此同时,也将为消费者带来更为安全、有效的医用敷料产品。
“这一类的产品日后价格可能会上升。”张太军告诉《未来迹Future Beauty》,他认为只是日常美容需求的话,没有必要用到III类的医用敷料产品,II类或普通面膜就能满足需求。“一定要搞清楚医用敷料和面膜之间的界限,不能把这个名称搞坏了,国家不断完善相关法律法规,也是有利于社会秩序的。”
柴振丽也表示,“实际上,有不少的化妆品企业不只做化妆品。在I类管控不严格的时期,很多都是做I类医疗器械的敷料产品,现在门槛拔高了很多,对企业的冲击是很大的。”
科技的进步为化妆品行业带来新的原料,新原料又会衍生为带有新功效的产品。当产品密度在市面上达到一定程度,相关法律法规也会随之完善,为人们提供一个更为清晰、细致的认知样本。这个过程必然也会伴随着市场的洗牌和重建。
本文部分参考资料:
[1]汤京龙、徐红等,医用敷料分类界定的初步研究,中国药事2014年第28卷第9期
[2]徐向彩、余晓芬、郑建、钱文文、梁泽伟,医用敷料类医疗器械分类界定工作的研究,中国医疗器械信息,2022年1月:1006-6586(2022)01-0017-03
[3]陈泓驰、位晓娟等,鱼胶原蛋白作为新型生物医用材料的研究进展,中国修复重建外科杂志,2018年9月;32(9):1227-1230



评论