文|氨基观察
Claudin18.2靶点,是体现中国创新药行业崛起的一面镜子。
据不完全统计,国内当前有50余款Claudin18.2靶向药处于研发阶段;该靶点不仅入局者众,参与角逐的技术路线更是多样,包括单抗、双抗、ADC和CAR-T。
悄然间,国内药企已经主导了Claudin18.2靶向药这一研发领域。在体现创新实力提升的同时,Claudin18.2靶点也体现了国内药企的担当所在。
创新药研发向来九死一生,Claudin18.2靶点更是如此。在今年11月份之前,全球还没有一款Claudin18.2靶向药踏过3期临床。
换句话说,该靶点的成药性尚未得到确证。入局的众多国内药企,都可能面临血本无归的局面。
好在,Claudin18.2靶点“是否能够成药”的问题,日前终于有了答案。
11月17日,日本药企安斯泰来宣布,其Claudin18.2抗体IMAB362首个三期临床成功:
针对Claudin18.2阳性/HER2阴性的复发性转移性胃癌患者,IMAB362化疗组合不仅达到无进展生存期主要终点,同时达到总生存期的次要终点。
率先冲出重围的安斯泰来,彻底打消了市场关于Claudin18.2靶点能否成药的疑虑,也宣告了国内药企的努力不会白费。
值得关注的是,Claudin18.2靶点的未来,大概率属于国内药企。因为IMAB362分子存在缺陷,虽然拿下FIC桂冠,却难以抵挡后来者的冲击。
那么,未来哪家国内药企能够胜出?
01 种子选手
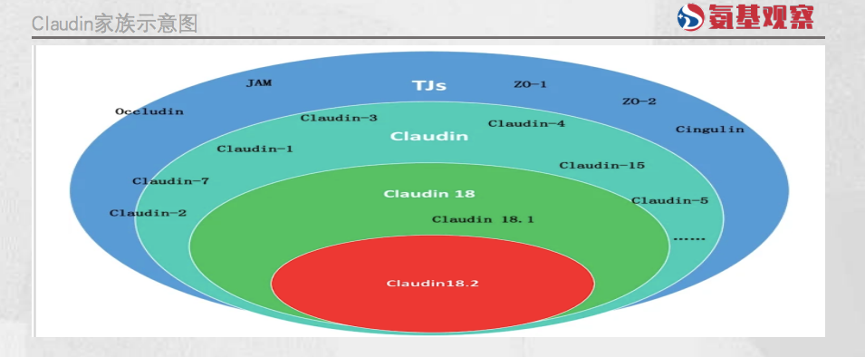
虽然Claudin 18.2靶点专为靶向药研发而生,但要想研发一款成功的Claudin18.2靶向药却不容易。药企们面临的一大障碍,是靶向药的选择性问题。
因为Claudin18.2的“同胞兄弟”Claudin18.1,在细胞外结构域中丰富表达,且与Claudin18.2仅相差8个氨基酸。
这导致,一旦靶向药对Claudin18.2的选择性不够,就容易错误的与Claudin18.1结合,影响药物治疗效果的同时,还会对人体带来较强的副作用风险。
毕竟,Claudin18.1与Claudin18.2不同,除了在肿瘤细胞上表达外,还广泛分布于人体的正常细胞中。
依此看,在国内众多入局Claudin18.2靶向药研发的药企中,有希望脱颖而出的种子选手大致需要符合两个条件:
一是具备高选择性分子研发能力,证明其未来具备可能性;二是至少拥有具备说服力的临床数据的验证,如果没有足够多的数据,问题就暴露不出来。
目前,同时符合两大基准的种子选手,暂时只有创胜集团和科济药业。
创胜集团的TST001是一款单抗,其通过独特的表位设计,仅与Claudin18.2结合,而不与Claudin18.1结合。
由于TST001是全球进展第二的Claudin18.2靶向药,安全性和疗效数据已得到充分验证。
2022年ESMO大会上,创胜集团公布了TST001联合CAPOX,作为晚期或转移性胃癌、胃食管连接部癌一线治疗的中期数据:
根据RECIST1.1标准,15例可测量病灶的患者疾病控制率高达100%,其中73.3%的患者肿瘤呈现部分缓解。
根据RECIST1.1标准,部分缓解指的是“肿瘤病灶直径之和,比基线水平减少至少30%”。这是实体瘤疗效评价标准中的关键指标,说明患者对治疗有积极响应。因此,中期数据中73.3%的缓解率,代表着更多的患者,有可能从治疗中实现生存获益。
在实现更高缓解率的同时,TST001的安全性也极为出色:
治疗中出现的不良事件(无论有无因果关系),超过80%为轻微的1-2级,且主要是恶心、呕吐、贫血等可控反应,并没有导致停药情况的发生。
这些数据无疑表明,TST001已具备成为种子选手的能力。
科济药业的CT-041则是一款CAR-T疗法。CT-041由经融合了人源化的抗Claudin 18.2单链片段变体的CAR遗传修饰的T细胞组成,具备有效靶向及消除在细胞表面表达Claudin 18.2的肿瘤细胞的可能。
目前,CT-041针对晚期胃癌/食管胃结合部腺癌的研究,已经处于确证性Ⅱ期临床实验。若后续临床数据优异,CT-041也将成为潜力黑马。
除此之外,包括信达生物等一众选手,也在埋头前进。众多国内各位种子选手正踌躇满志,向Claudin 18.2靶点的至高点发起冲击。
02 虎口夺食
面对IMAB362这个暂时性的领先者,国内企业各有竞争策略。不同选择,根植于这些公司过往经验,可调动资源和对自身产品的信心。
大部分企业选择从末线治疗做起,比如科济药业的CT-041或康诺亚的Claudin 18.2 ADC药物CMG901等。

也可以理解,对于新疗法来说,末线治疗是最合适的切入点,这既符合伦理也最保险。
但对于肿瘤药物来说,只有成为一线疗法面向更多患者,才能最大程度证明其价值所在。因此,全球重磅炸弹药物的研发路径相对一致,经过多年临床试验,实现从末线再到一线的扩展。
一线疗法,必然也是Claudin18.2靶向药的至高点。也正因此,安斯泰来的单抗药物IMAB362,从一开始就选择联合化疗冲击胃癌一线疗法。
部分国内药企没有避其锋芒,而是选择虎口夺食,比如创胜集团的TST001。
正如上文提及,TST001正在开展联合CAPOX,作为晚期或转移性胃癌、胃食管连接部癌一线治疗的临床研究,且进度全球第二。目前,TST001该研究的中美III期临床试验正处于计划阶段。
与此同时,TST001又和胃癌新晋一线疗法O药展开联合攻坚,形成了差异化布局。
值得注意的是,创胜集团是全球首家开展Claudin18.2/PD-1/化疗联合疗法的公司,有望引领下一轮一线胃癌治疗领域的方案,拉开与其它选手的差距。
就现状而言,安斯泰来的IMAB362/化疗组合,能否挑战O药/化疗组合,还有待进一步的临床数据披露。根据安斯泰来披露的2期临床数据:
针对Claudin18.2高表达人群,IMAB362/化疗组合有一定优势(非头对头),但鉴于Claudin18.1、Claudin18.2的蛋白质序列重合度高达92%,因此筛选出真正的Claudin18.2高表达患者仍是一大挑战,这是影响该疗法“成绩”的一个变数。
相对而言,同样是挑战O药/化疗组合,创胜集团的TST001/O药/化疗组合胜算更大。
一直以来,PD-1抑制剂的疗效,都受到患者PD-L1表达量的制约。患者PD-L1表达量越高的群体,临床获益情况越明显;反之,则获益情况越差。
这也是O药/化疗组合,在一线治疗胃癌过程中的BUG所在。
虽然,O药/化疗组合对该群体所有患者都有效果,但对PD-L1低表达(CPS<5)患者群体,获益风险比存在争议。
针对低表达患者群体,O药/化疗联合疗法的生存获益有所下降,而风险(副作用)则会相应提升(约10%)。
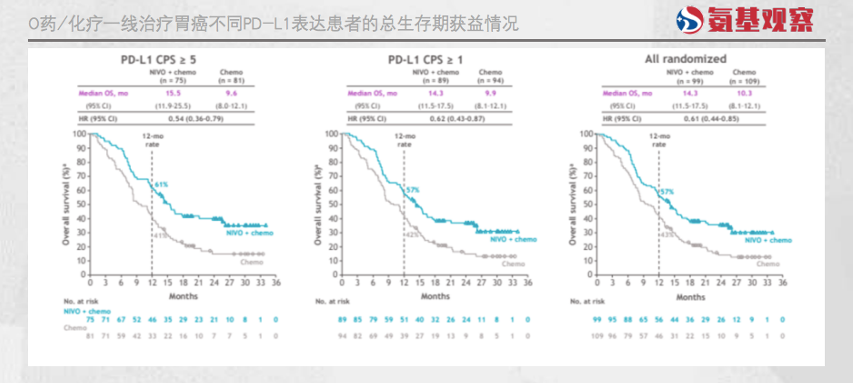
也正因此,欧盟虽然批准O药/化疗一线治疗胃癌,但仅限于PD-L1 CPS ≥5的患者;日本批准O药/化疗一线治疗胃癌没有限定群体,但规定PD-L1在CPS<5或未知的情况下,应考虑患者的整体健康状况和获得后续治疗的机会,再决定使用O药/化疗或单独使用化疗的治疗手段。
而大部分Claudin18.2阳性胃/胃食管腺癌患者,都属于PD-L1低表达患者。一项在中国展开的研究显示, 约80%的Claudin18.2阳性胃/胃食管腺癌患者PD-L1 CPS<5。
这意味着,强悍的O药/化疗组合,在一线治疗Claudin18.2阳性胃/胃食管腺癌患者过程中,充满着变数。
正是基于此,创胜集团开展了TST001联合O药的一线治疗胃癌的临床研究。
理论上,Claudin18.2靶向药可促进T细胞浸润和抗原递呈,从而提高免疫检查点抑制剂的疗效。
的确如此,在临床前模型中,创胜集团的TST001在加入PD-1抑制剂及化疗后,就产生了协同效应。
这一结果,无疑表明TST001/O药组合有望解决O药/化疗一线治疗胃癌存在的局限性,为那些可能无法从抗PD-(L)1治疗中受益的患者,提供治疗新选择。
综合来看,在一线胃癌领域围追堵截,另辟蹊径的创胜集团,面临的变数或许也会更小。
03 决胜极限
对于一款创新药来说,能否给更多患者带来治疗选择,是衡量其价值的唯一要素。
就Claudin18.2靶向药物而言,判断谁能更上一层,首先要看能否坐稳一线疗法,这是最基础的竞争力;其次要看能否覆盖中表达,甚至低表达患者,这是决定天花板高低的最核心因素。
IMAB362的缺陷在于,其分子亲合力较弱,导致疗效受到患者肿瘤细胞Claudin18.2表达比例的牵制,只对高表达患者有效。
根据ClinicalTrials.gov,IMAB362联合CAPOX作为晚期或转移性胃癌及胃食管连接部癌一线治疗的三期临床,针对的只有Claudin18.2高表达(≥ 75%)患者。
而在所有实体瘤中,Claudin18.2高表达患者仅占33%—37%;在患者群体规模最大的胃癌领域,高表达患者占比更是仅有20%左右。

显而易见,Claudin18.2靶点争夺战中,只有满足低表达患者的临床需求,才更具临床价值。
目前来看,国内药企脱颖而出的关键,是“优化”分子的技术实力。
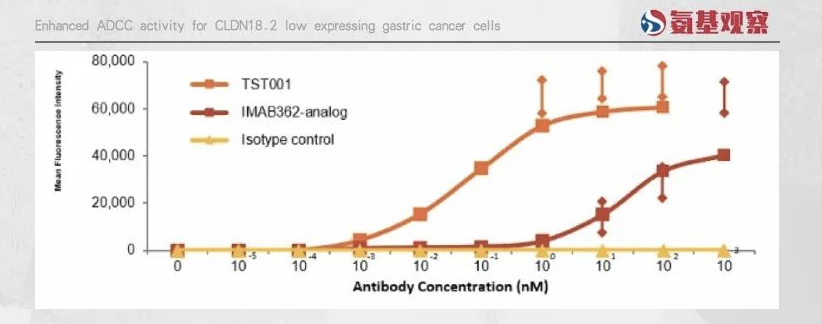
比如,创胜集团的TST001,通过不同的表位设计、降低抗体Fc区域的岩藻糖含量两大举措,使其抗体具备与肿瘤细胞更高的亲和力、和NK细胞更好的结合效率的两大潜在优势,最终拥有满足低表达患者、超越IMAB362的潜力。
如下图所示,根据创胜集团研究,TST001的ADCC活性显著优于IMAB362。
这一优势让TST001具备覆盖Claudin18.2中表达患者的可能。如下图所示,根据今年9月创胜集团在ESMO公布的临床数据,TST001针对中表达患者效果同样突出。
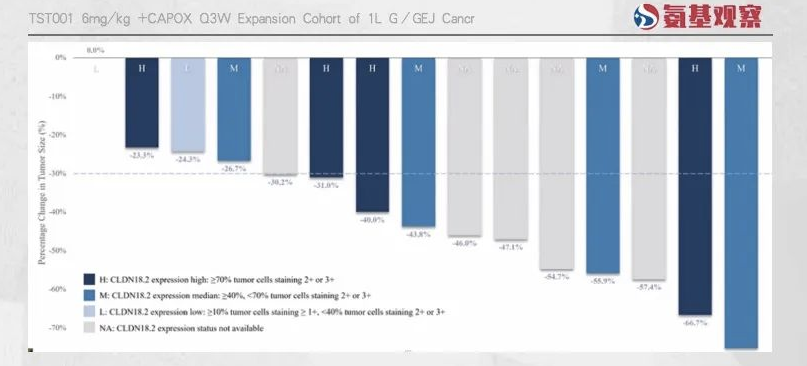
与此同时,创胜集团表示,未来还会在低表达患者中展开临床研究。若TST001最终能够覆盖到中、低表达患者,无疑能够超越IMAB362,做到全面领先。
当然了,不仅是创胜集团,国内其它药企均有机会通过自身能力,设计出战斗力更强的分子,上演后来居上的好戏。
信达生物布局多个技术路线的目的就在于此。目前来看,其Claudin18.2/CD3双抗IBI389或有一定潜力。
IBI389“一只手臂“结合肿瘤细胞上表达的Claudin18.2,“另一只手臂”结合T细胞上的CD3,或具有高效率和高选择性杀伤Claudin18.2肿瘤细胞的能力。
临床前结果表明,在Claudin18.2低表达的细胞系中,IBI389仍能与肿瘤细胞结合,表现出明显的抗肿瘤效应。
这意味着,IBI389后续有望覆盖Claudin18.2中低表达人群,扩大潜在获益人群范围。当然了,IBI389能否达到目的,还需经过人体临床研究的检视。
参考海外药企研发历史,不管任何“技术”都存在变数。比如,在今年完成1期临床之后,安进的Claudin18.2/CD3双抗AMG 910已经悄悄的从公司管线中“消失”。市场推测,安进的AMG 910或许遇到了安全性问题。
总体而言,如何基于自身技术实力,改造出更优效的分子,以触达更广泛的患者群体,也是所有管线还处于早期阶段的国内药企面临的挑战。
当然了,不管怎么说,随着安斯泰来证明了Claudin18.2靶点的成药性,Claudin18.2靶向药物市场正超预期发展,具备竞争优势的公司,终究会跑得越来越快。



评论