文|氨基观察
过去一年,国内新冠口服药的热度,几乎全部由3CL蛋白酶抑制剂相关概念撑起。
明确的成药机制,此路可行是前提;辉瑞的成功,则让预期变得可见。在这两点上,3CL蛋白酶抑制剂有着无可匹敌的逻辑。
不过,小分子药物的抗病毒路径,不止有3CL蛋白酶。
从机制来看,干扰与复制相关的宿主因子,抑制新病毒颗粒的产生,抑制病毒编码的酶,或阻止病毒进入宿主细胞,都具有潜在可能。
其中,部分正确答案也早已写下,比如RdRp(RNA依赖性RNA聚合酶)路径。
作为最早获FDA批准的小分子药物,瑞德西韦的成功,已证实了该路径的可行性。只是,作为注射剂的瑞德西韦,因为依从性劣势,把C位让给了后来者Paxlovid。
眼下,少数冒险者正“以身犯险”,试图为瑞德西韦正名:他们通过创新升级的方式,希望获得疗效与依从性等多重升级的口服药,以站上舞台中央。
这是一场颇具挑战的方向,它有巨大的不确定性。但幸运的是,部分冒险者们已走过重重关卡,距离“上岸”越来越近。
12月28日,君实生物在医学顶级期刊《新英格兰医学杂志》上发表了VV116头对头PAXLOVID的临床数据。结果显示:
VV116的疗效非劣于PAXLOVID,安全性更占优势。
这或许也预示着,新冠口服药之争,在往“两极争霸”的局面演变。
01 不容忽视的路径
从一开始,医学界就认为,RdRp是对抗新冠病毒的前途靶点。原因不少,明确的作用机制与RdRp高度保守的特点最为核心。
作用机制方面,RdRp是RNA病毒遗传物质复制和转录的关键酶,其功能的丧失意味着病毒难以“繁殖”。因此,RdRp被认为是抗RNA病毒最有希望的靶点之一,新冠病毒也不例外。
与此同时,RdRp的“保守”程度超乎想象,不说新冠病毒不同毒株,即便是不同类型的RNA病毒,均显示出具有相近的结合位点。例如,RdRp在新冠病毒和“非典”病毒中的结构,相似度为96%。
这一特点,能够为药物开发带来两大潜在好处。一方面,一款行之有效的RdRp抑制剂,不惧新冠病毒突变。你也知道,新冠病毒最大的特点,是突变不断;
另一方面,老药或许能够新用,缩短研发进程。参照过往历程,不少RdRp抑制剂均具有一定的泛打击能力。
的确如此。率先进入公众视线的瑞德西韦,就是转道而来的“老将”。
10年前,瑞德西韦被希望用于对抗埃博拉病毒;但2020年以来,随着众多研究的推进,人们逐渐发现,瑞德西韦是对抗新冠病毒的一把“利刃”。
作为一款RdRp抑制剂,瑞德西韦作用类似于“终结者”:
其在带有病毒遗传物质链的复制过程中,引入了一个终止病毒复制的构件NTP,这一错误的构件和ATP竞争结合RdRp,并抑制RdRp酶活性,终止病毒复制过程。
2021年12月26日,《新英格兰医学杂志》发布的临床数据显示,在有症状且疾病进展高风险的未住院新冠患者中,相较于安慰剂,瑞德西韦能够将住院或死亡风险降低87%。
针对相同群体,被公认为全球最佳的Paxlovid,这一数字为89%。在非头对头研究的情况下,瑞德西韦与Paxlovid展现了势均力敌的态势。这一点,或许出人意料。
实际上,后续在与奥秘克戎毒株的对垒中,瑞德西韦表现似乎更胜一筹。如下图所示,根据体外测试IC50数据,针对多个奥秘克戎毒株,瑞德西韦活性受到的影响最小。
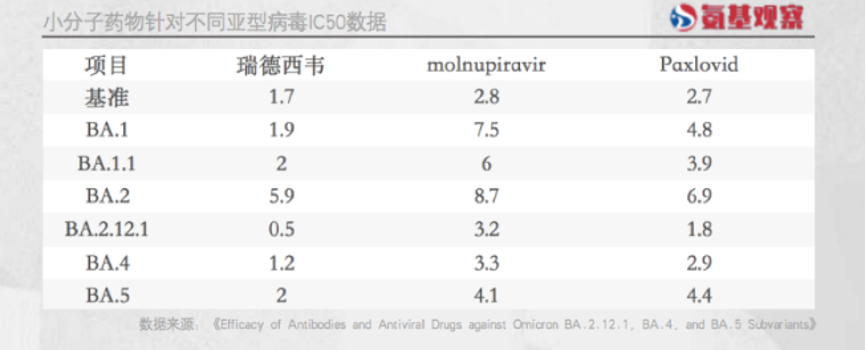
鉴于突出的抗新冠病毒能力,早在2020年5月1日,瑞德西韦就获得FDA紧急使用授权,用于重症新冠住院患者的治疗,随后被拓展至非重症患者。
2020年10月22日,FDA批准瑞德西韦上市,其由此成为第一个正式获批用于新冠治疗的药物,地位可见一斑。
02 异军突起的方向
不过,新冠口服药之争,不仅是疗效的比拼,还涉及安全性、可及性等综合维度的对垒。
需要静脉注射的瑞德西韦,在可及性方面处于劣势地位,吃了大亏。
瑞德西韦需要在门诊给药,进行连续3天的输液。虽然这比住院患者疗程要短,但相比口服药物,瑞德西韦就要麻烦得多。
因此,相比于辉瑞的Paxlovid,瑞德西韦率先突围却“存在感”不高,其知名度甚至不如效果远不及自己的Molnupiravir。
但是,这并不代表瑞德西韦不能逆袭。
虽然瑞德西韦不适合作为口服药物,但其在人体的代谢产物母体核苷(GS-441524),具有“口服”潜力,且拥有更好的抗病毒能力。
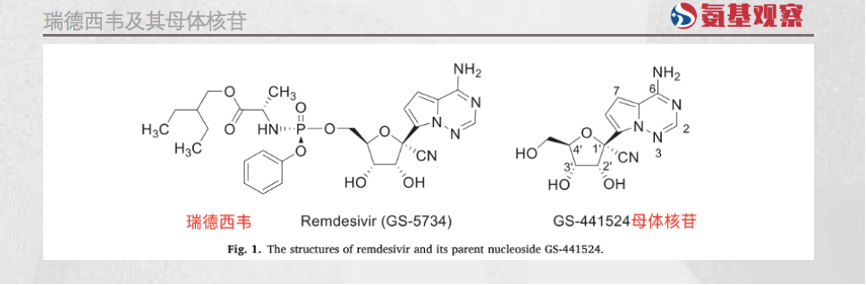
这意味着,通过对GS-441524的改造,瑞德西韦具备“升级”可能。这一过程并不容易,但鉴于瑞德西韦成功在前,全球依然有少数实力机构展开攻坚工作。
吉利德便是其中一员,其研发了口服版本的瑞德西韦GS-5245,用于向人体细胞输送GS-441524。目前,GS-5245已进入三期临床,并且拿到了FDA的快速通道资格。
国内企业同样没有落下。君实生物的VV116,也是基于GS-441524改造而来,且“青出于蓝而胜于蓝”。
相比于瑞德西韦,在具备口服优势的同时,VV116还具有两大潜在优势。
第一,更强的抗病毒能力。如下图所示,VV116及其代谢产物(X1)的半数最大有效浓度(EC50)约是瑞德西韦的1/5,甚至低于GS-441524。
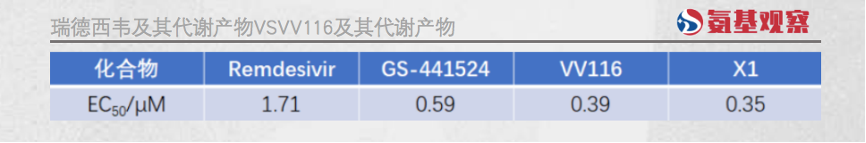
所谓EC50,是指是能产生50%的最大效应的药物浓度,数值越低说明效果越好。也就是说,VV116具有更高的活性,更强的抑制作用。
第二,VV116更有针对性。瑞德西韦最初的设计,是用于增强对丙肝病毒的抗病毒活性。所以,瑞德西韦具有肝脏靶向特性。但新冠患者肺才是受影响最大的器官,专业有些许偏差的瑞德西韦,疗效或许有所“折扣”。
相比之下,VV116专门为抗新冠病毒设计,针对性更强。在小鼠中开展的实验显示,VV116代谢产物X1广泛分布在肠、肺、肾、肝、心、脑等组织中,其中大部分是新冠病毒感染的首选靶标。
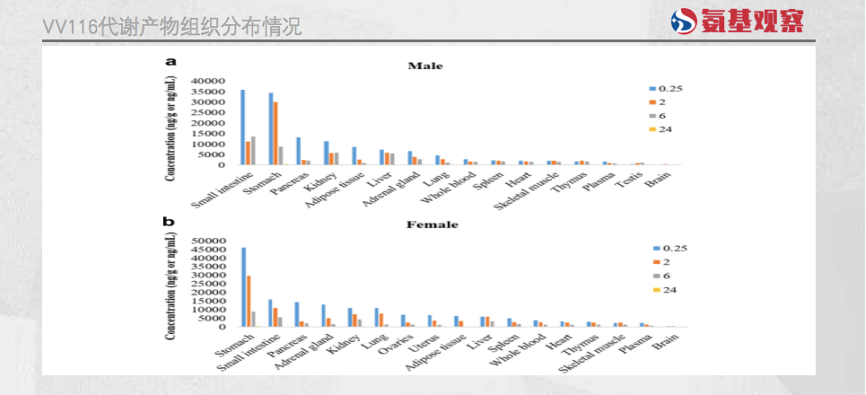
VV116的这一特性,将为其治疗新冠感染带来潜在的优势。
实力选手越聚越多,多项重磅的临床试验也已经上路,口服RdRp抑制剂通往抗疫市场的大门,早已被撬开了一道门缝。
透过缝隙,众多选手已经能够看到门外的风景,但距离亲身跨出门外,似乎还差了些什么。
03 共筑抗疫城墙
在不少业内人士眼中,口服RdRp抑制剂距离成为抗疫担当,始终差了一份足够好的数据。
尽管一批先行者已披露相应的临床数据,却未能撕下“有待验证”标签。
全球首款新冠口服药Molnupiravir高开低走,最终有效性仅30%,且存致突变可能;率先撞线的国产新冠口服药阿兹夫定,也迟迟未能拿出证明自己的数据,且动物实验中出现的遗传、生殖毒性问题也让人担忧。
没有人否认口服RdRp抑制剂的潜力,但先行者不算理想的数据,并不能打动所有人。好在,君实生物的VV116终于带来了好消息。
12月28日,君实生物在NEJM期刊上发表了VV116头对头PAXLOVID的临床数据。结果显示,针对伴有进展重症高风险的轻至中度Covid-19成人患者,VV116 治疗组的至持续临床恢复时间非劣于Paxlovid。
具体来看,VV116组的恢复时间更短,中位症状恢复时间为4天,Paxlovid组症状恢复时间为5天。
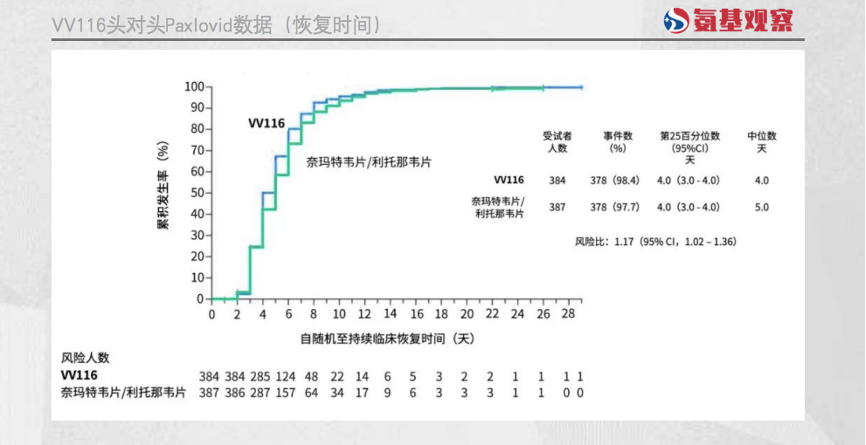
安全性方面,VV116具有一定优势。VV116治疗组的AE发生率,低于Paxlovid组(任何级别的AE:67.4% vs. 77.3%,3或4级AE:2.6% vs. 5.7%)。
更高的安全性,不逊色的疗效,注定了VV116有潜力携手Paxlovid,共筑防疫城墙。在当前,全球抗疫先锋仅有Paxlovid远远不够。
原因在于,并非所有符合特征的患者群体,都适用于Paxlovid。Paxlovid的成分之一利托那韦因通过肝脏的CYP3A4酶代谢,与众多药物存在相互作用,进而影响彼此的疗效。
Paxlovid的用药对象,更多是患有多种慢性病的老年人。而相互作用的药物,不少是老年人平时吃的许多药物(包括降压药、降脂药等)。显而易见,Paxlovid对部分无法停用基础用药的患者十分不便。

而VV116不抑制或诱导主要药物代谢酶或抑制主要药物转运蛋白,因此与伴随药物相互作用的可能性较小。这也意味着,VV116有能力够惠及Paxlovid难以触达的人群。
从瑞德西韦到VV116,均在顶级期刊《新英格兰医学杂志》发表最新研究数据,似乎是一种传承:
前者为RdRp抑制剂的研发指明了方向,而后者则为该技术路线的口服制剂研发注入信心。
12月30日,药监局附条件批准默沙东的Molnupiravir上市,也进一步说明了口服RdRp抑制剂有能力为“抗疫”做更多贡献。
随着VV116越来越多的临床数据披露,也将为其在国内乃至全球上市带来强有力的支持。
对于期待口服RdRp抑制剂的人们来说,这应该是一个值得期待的消息。



评论