据悉,中国在2017年已经成为全球第二大医美市场,同样也是全球增速最快的国家之一。另一方面,国家对医美行业的监管力度在2022年就开始明显增强,医美市场呈现出合规化发展大趋势。此次大会分论坛“第三届糖类药物创新与发展会议”及医疗美容机构规范运营会议汇集了多名重磅专家学者、企业家及其他业内人士,共同研讨透明质酸医美市场的高质量发展。
透明质酸医美应用广泛,市场空间巨大
透明质酸是一种天然直链多糖,具有良好的保水性、润滑性、黏弹性等优势,广泛应用于医疗、化妆品、食品等行业中。其中,在医疗美容领域中,透明质酸可作为填充剂、水光针和医美术后修复,而透明质酸已经成为填充剂市场上份额最大的原料。
在第三节糖类药物创新与发展会议上,华熙生物科技股份有限公司副总经理、首席科学家郭学平博士详细介绍了透明质酸作为填充剂、水光针和术后修复的适应症及对原料的特性要求等。郭学平博士提及,上世纪90年代,透明质酸作为医美填充剂首先在国外出现。第一款真正进入市场的产品来自瑞典Q-Med开发的瑞蓝,随后衍生发展到欧洲各国,医美填充剂产业也主要集中在欧洲。据悉,瑞蓝于2008年在国内上市。

而在国内,华熙生物于2012年获批上市了第一款润百颜透明质酸填充剂,这是我国首个获CFDA批准的国产透明质酸填充产品,打破了进口材料对国内市场的垄断。经过十年的发展,华熙生物已先后上市二十多款医美产品,打造了定位“面部年轻化专家”的医美终端品牌润致,其中“润致娃娃针”是国内少有的拥有三类医疗器械资质的“长效水光”产品。
资料显示,华熙生物不仅是国内首家具有透明质酸(玻尿酸)药用辅料资质的企业,也是国内首家具有透明质酸(玻尿酸)原料药批准文号并通过GMP认证的生产厂家。在不同类别的透明质酸产品中,医药级产品的门槛最高——医药级透明质酸产品对内毒素的含量指标最为严格,因此对产品纯化、精制等环节有很高的技术要求。依靠深厚的科研创新能力,华熙生物的医药级透明质酸原料产品质量高于欧洲药典、日本药典及中国药品质量标准,主要质量参数核酸、内毒素等杂质水平分别是欧洲药典国际标准规定值的1/50和1/20。
未来,透明质酸医美有多重可能性。郭学平博士认为,未来透明质酸医美向“透明质酸+”发展,透明质酸+羟基磷灰石、透明质酸++胶原蛋白等均是医美新产品的研究趋势,医美市场的潜力将更为广阔。
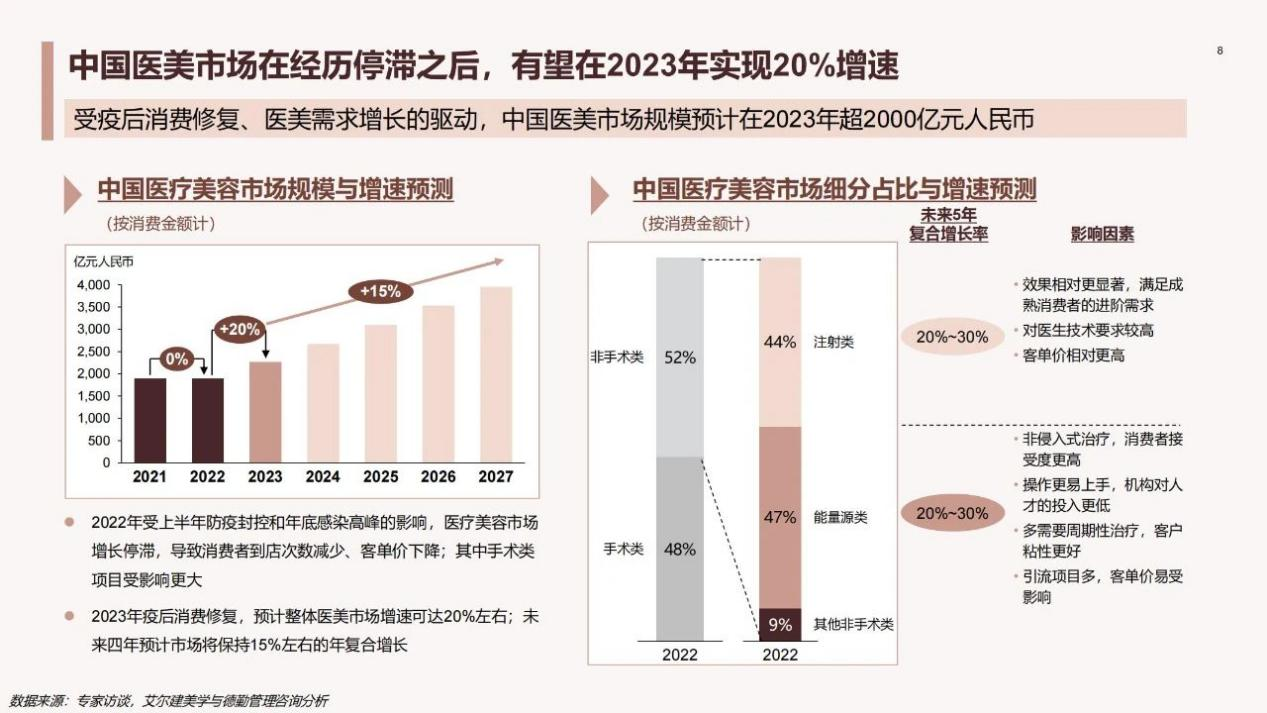
另一方面,国人消费能力增长,医美消费意愿提升,也给透明质酸医美市场发展注入活力。德勤《中国医美行业2023年度洞悉报告》显示,中国医美市场在消费金额上有望在2023年实现20%增速,且未来四年预计市场将保持15%左右的年复合增长,发展可期。
强监管时代,华熙生物助力透明质酸医美合规化
庞大的医美需求对市场的合规运营也提出了不小的挑战。一方面,医疗美容产品注射属性决定了其存在潜在风险,另一方面,执业机构的资质、操作资质、临床规范使用等均存在合规性风险。
北京中闻律师事务所资深医美律师于鲲在医疗美容机构规范运营会上提到,2022年9月-2023年2月,十一部委联合发布的关于医疗美容行业专项治理行动中显示,272个案例共计处罚金额超2亿元。违规事项主要集中在使用不合格医疗器械、虚假宣传及无证经营三方面。
今年3月15日,央视3·15曝光了海茂生物科技有限公司等将“妆字号”备案产品用于注射的违法企业,加强了医美行业监管。实际上,国家近几年不断加强对医美行业的监管力度,继我国首部针对化妆品注册备案管理的《化妆品注册备案管理办法》施行后,配套政策相继出台,倒逼国内化妆品企业承担更多主体责任。2021年11月,国家药监局发布了关于征求《医疗器械分类目录》调整意见的通知,规定注射用透明质酸钠溶液按照III类器械监管,该通知已于2022年3月正式落地。到2023年,国家不仅对准入门槛以及医疗器械、经营范围等一系列内容合规性的监管,还对医美的营销,宣传等行为进行了规范。《医疗美容广告执法指南》颁布后,医疗美容行业已经迈入了强监管的时代。
生产企业及医美机构运营必须适应新政策、新要求,提高行业自律,才能在医美市场合规发展大趋势下生存,而华熙生物等行业头部企业将更有机会发挥自身竞争优势,引领医美行业高质量发展。

华熙生物始终致力于推动医美合规化。3月16日,华熙生物润致发布消息,向公众科普合规医美产品的识别方法,包括“登陆国家药监局查询批号”、“国家NMPA批准且为三类医疗器械才是合规可注射产品”等重要的“知识点”。华熙生物副总经理、首席运营官郭珈均在会上表示,公司开展的润致规范运营之旅已经在全国范围内20多家城市开展,覆盖了数百家医美机构和上千名医美从业人员。
颜值经济带动更多消费者尝试医美,医美渗透率不断提高,合规化大趋势也符合国家质量强国的政策。医美行业各方只有响应国家政策,提高合规运营水平,助力行业高质量发展,才能共享行业红利。

评论