界面新闻记者 |
界面新闻编辑 | 谢欣
6月12日,港股创新药企嘉和生物公告,其用于治疗复发/难治性外周T细胞淋巴瘤(PTCL)的PD-1产品杰诺单抗注射液(GB226)上市申请未获国家药监局批准。
6月12日,界面新闻拨打嘉和生物投资者热线电话及发送邮件询问杰诺单抗未通过国家药监局批准的原因,截至发稿未获回复。
嘉和生物的股价也从上市时的32.2港元/股一路跌倒如今的不足2港元/股。6月12日,嘉和生物报收1.78港元/股,跌1.11%。
实际上,早在6月9日,国家药监局官网的待领取信息中就出现了嘉和生物的杰诺单抗注射液的身影。药品通知件是指国家药监局在审评过程中发现存在问题或需要补充资料的情况下,向申请人发出的通知书。收到药品通知件后,申请人需要在规定时间内回复或补充相关资料,否则将被视为放弃申请。
在嘉和生物的杰诺单抗注射液的信息页面中,其药品批准问号标注为无。这也意味着,在6月9日时,嘉和生物的杰诺单抗注射液的上市之旅就已被宣判失败。

嘉和生物在公告中没有透露撤回申请的具体原因和重新提交的时间表。嘉和生物表示,公司预计其他临床试验或本公司其他候选药物的研发进展将不会受到影响。
嘉和生物是在2020年通过港股18A政策上市的一员,其核心业务为肿瘤及自身免疫药物的研发及商业化。它也是首家在港上市的中国肿瘤免疫治疗公司。
杰诺单抗注射液是嘉和生物寄予希望的核心产品之一,在国内PD-1内卷的情况下,嘉和生物将申请上市的适应症放在了治疗复发或难治性外周T细胞淋巴瘤。这也是目前首个在中国境内乃至全球申请这一适应症的PD-1单抗。
外周T细胞淋巴瘤属于罕见病,是一种罕见而恶性的非霍奇金淋巴瘤(NHL)亚型。据头豹研究院,外周T细胞淋巴瘤每年新增患者在1.3万-1.6万人,患者数量相对较少,市场空间有限。不过,外周T细胞淋巴瘤患者预后差,在全球范围内都存在极大的未满足临床需求。无论在中国还是美国,都尚未有PD-1单抗被批准用于该疾病的治疗。因此,嘉和生物想将其首个上市PD-1的适应症瞄准在罕见病领域,也可以说是后来者在面对PD-1内卷下的“奇招”。
在此之前,杰诺单抗的上市之旅走得也不算顺利。杰诺单抗于2020年递交上市申请,7月22日获得国家药监局的受理,并于7月28日被纳入优先审评名单。嘉和生物在2022年年报中表示,杰诺单抗成为首款NDA获得国家药监局接纳的用于治疗复发或难治性外周T细胞淋巴瘤的PD-1。嘉和生物还预计将在未来的半年至一年内推出杰诺单抗。
嘉和生物的杰诺单抗上市申请主要基于Gxplore-002试验的数据,这是一项多中心、开放标签、单臂II期临床试验,评估了杰诺单抗用于治疗复发或难治性外周T细胞淋巴瘤的疗效及安全性。该试验显示,杰诺单抗治疗复发或难治性外周T细胞淋巴瘤患者具有显著的疗效:IRC评估的ORR为36.3%,PTCL主要亚型均能获益,其中ALK阴性间变大细胞淋巴瘤ORR可达58.3%;此外,既往接受西达本胺治疗失败的受试者仍有33.3%获得缓解。
嘉和生物也在2020年筹建了商业化与销售团队。可见,嘉和生物当时对杰诺单抗最终能通过审批上市是抱有很大希望。不过,长达三年的审批之后,杰诺单抗最终还是被否了。
嘉和生物曾是国内明星创新药企,也是在PD-1上较早进行布局的企业,不过该公司自从成立起,就经历了不断的股东与业务上的变动。就在杰诺单抗在审批的这段时间。嘉和生物的创始人周新华辞去集团总裁、执行董事的职位,由公司首席执行官王晓东接任。作为公司创始人,嘉和生物公告并未明确解释周新华的离职原因。仅表示,周新华决定投放更多时间于其他事务,并无就其辞任对公司提出任何索偿,且与董事会之间并无意见分歧。
截至目前,嘉和生物仅一款商业化产品在2022年2月23日上市的为用于治疗风湿关节炎、强直性脊柱炎、银屑病、成人溃疡性结肠炎、成人及6岁以上儿童克罗恩病及瘘管性克罗恩病等6+1适应症的佳佑健(GB242,英夫利西单抗生物类似药)。这款药比杰诺单抗晚一点却顺利上市。
虽然英夫利西单抗在全球也是一款“重磅炸弹”级的产品,但在治疗手段越来越丰富的自身免疫性疾病领域,英夫利西单抗即干不过“老大哥”阿达木单抗、还面临着多个后来小弟的挑战。
而在中国市场,英夫利西单抗的表现也缺乏亮点。2020年,在中国公立医疗机构终端,该产品销售额约5亿元,同期,阿达木单抗是10亿元。并且在嘉和生物的英夫利西单抗上市之前,国内已有海正药业、迈博药业的同款类似药获批,嘉和生物早已没了先发优势。
佳佑健一上市也就进了集采。嘉和生物披露,佳佑健已在17个省市完成挂网采购,销售额约达1190万元。这部分相对与嘉和生物的研发投入来说是杯水车薪。据2022年年报,嘉和生物的研发费及临床试验开支为2.4亿元。
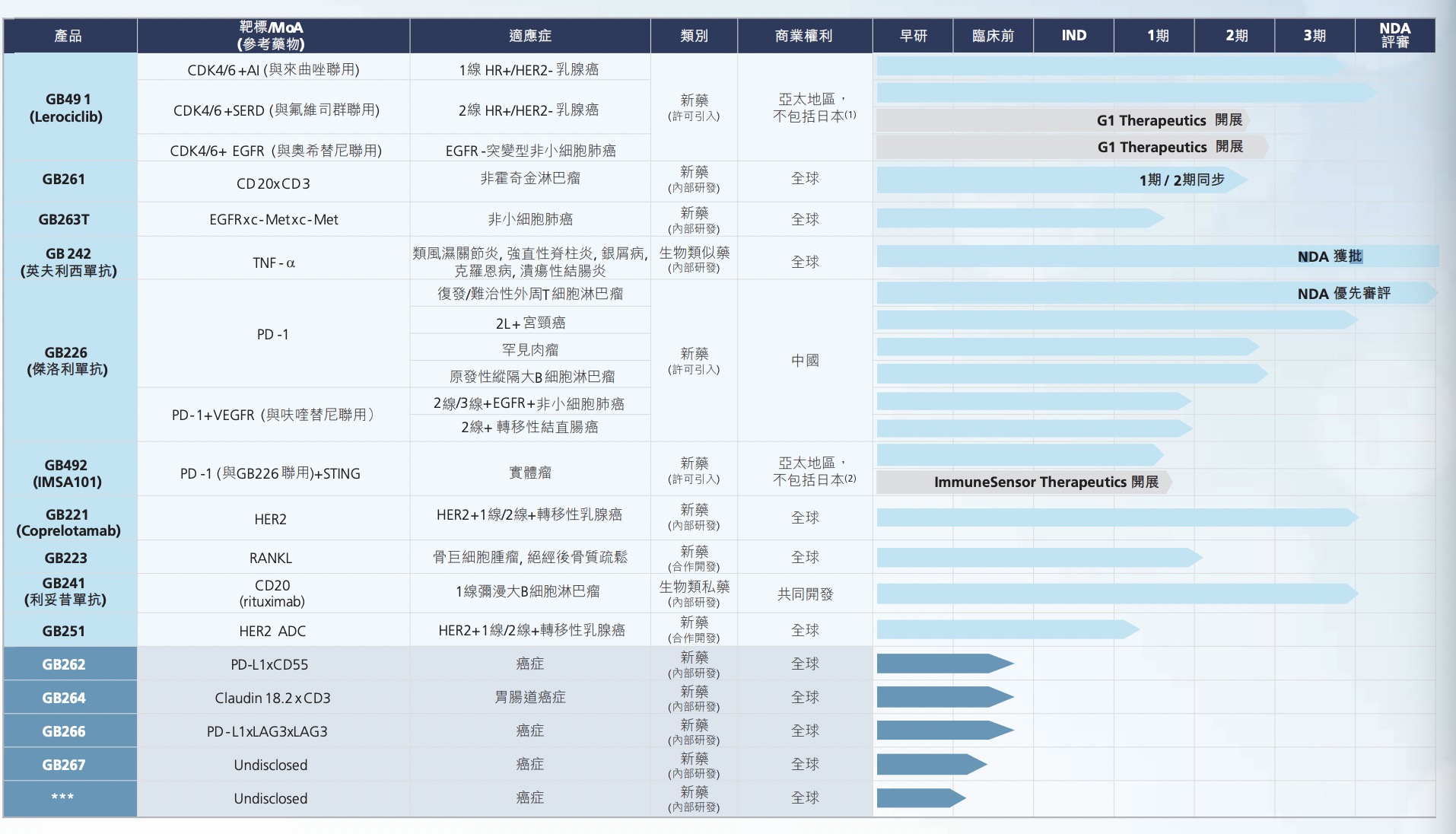
此外,盐酸来罗西利片的二线用药HR+HER2-乳腺癌适应症是嘉和生物目前进度最靠前的产品,嘉和生物的其他管线则进度较落后。其中,GB214和GB221进入III期临床试验,其余产品均为I期或I/II期临床试验。




评论