文|MedTrend医趋势
6月29日,张锋团队在顶尖学术期刊《自然》上发表突破性研究:宣布Fanzor蛋白首次在真核生物中发现受RNA引导的DNA切割酶。通过进一步的优化,Fanzor有望成为较现有CRISPR/Cas系统更为精确、更易被递送至人类细胞的基因编辑工具。
这不是近期基因编辑领域唯一的好消息。
6月8日,美国FDA受理了CRISPR和Vertex两家公司共同开发的基因编辑疗法exagamglogene autotemcel(exa-cel)用于治疗严重镰状细胞病(SCD)和输血依赖性β-地中海贫血(TDT)的上市申请,并授予其治疗SCD的优先审评资格。
*** 针对SCD和TDT的PDUFA(最后审核)日期分别为2023年12月8日和2024年3月30日。
CRISPR Therapeutics(市值47.98亿美元),2013年成立于瑞士。
创始人是CRISPR-Cas9技术发明者兼诺贝尔化学奖获得者Emmanuelle Charpentier。
在FDA受理消息发布后,其股价当日高涨6%,目前是市值最高的基因编辑企业。
这是全球首款进入上市流程的基因编辑疗法,意味着经过了11年的开发竞赛,基因编辑疗法的“终点线”终于有了曙光。
基因编辑是一种革命性的治疗技术,通过精确地修改生物体基因组,以纠正遗传病变或疾病相关基因的突变;有望治愈一系列遗传性疾病、癌症、罕见病等。
目前技术包括ZFNs、TALENs、Prime Editing、CRISPR-Cas9等(CRISPR-Cas9凭借高效、简便、经济的特点,成为目前最常用的基因编辑工具)。
从CAR-T到mRNA再到基因编辑疗法,现代制药产业或许将真正进入小分子化药、大分子生物药、CGT(细胞和基因疗法)并驾齐驱的时代。
而伴随这一时代到来,从监管机构审核范式到企业管线优先级的调整,或都将被“重写”。美国和中国都已有新举措。
01 美国已将CGT提升到国家战略高度
基因编辑疗法所属的CGT(细胞和基因疗法)领域,是一个被誉为未来医学的重要领域;或将最有希望治愈癌症、罕见病、遗传疾病等;美国已将其上升到国家战略高度。
截止目前,全球TOP20的药企均已入局;女股神木头姐(Catherine Wood)、全球首富马斯克都曾表示“下一波超级公司”就将诞生在细胞和基因疗法领域。

CGT(细胞和基因疗法)分类,CR:美国基因与细胞治疗学会 (ASGCT)
近日,美国FDA表示,从2023年开始,CGT(细胞和基因疗法)获批将进入爆发期,每年预计将超过10款,对应的基因编辑疗法审核面临前所未有的挑战。
首先,基因编辑疗法或将永久改变人体基因组,因此需要格外严格审查;
其次,作为一个全新领域,以此前的(小分子、大分子药物)标准来审查基因编辑疗法或不再适用。
为此,美国FDA专门制定了两步方案,来推进CGT审核的高效、安全。
第一步:2023年3月正式成立“超级办公室”。这是FDA生物制品评估和研究中心(CBER)成立的第一个超级办公室,旨在简化流程,提高审批效率。
第二步:修订监管范式,使之更专业、精准。包括:
调整CMC框架,该框架最初是为小分子药物设计的。
专门为CGT产品审核,制定监管范式,以促进安全和有效的基因疗法发展,特别是对那些未满足需求的罕见疾病。
*** CMC(Chemistry, Manufacturing, and Controls)框架是一种在药品开发和注册过程中广泛应用的概念和方法。
负责人Wilson Bryan表示,目前“超级办公室”人手非常紧缺,将在未来4-5年内增加约100名员工。
美国对基因疗法的重视不止于此,2023年3月,白宫发布了一份长达64页的报告,重点发布针对五大领域的具体目标,其中就包括改善CGT产能和基因编辑技术。
1、改善CGT产能
5年内,提高CGT疗效,扩大用于开发细胞疗法的技术,使患者的细胞存活率至少达到75%。
20年内,扩大CGT生产规模,并将其生产成本降低10倍。
2、先进的基因编辑技术
5年内,提高基因编辑效率;进一步开发用于临床的基因编辑系统,以便在几乎没有副作用的情况下,治愈10种已知遗传疾病。
20年内,加强生物制造生态系统;每年至少生产500万剂量的治疗性基因编辑系统。
02 全球市场:热门赛道拥挤,TOP药企尝试“调转方向”
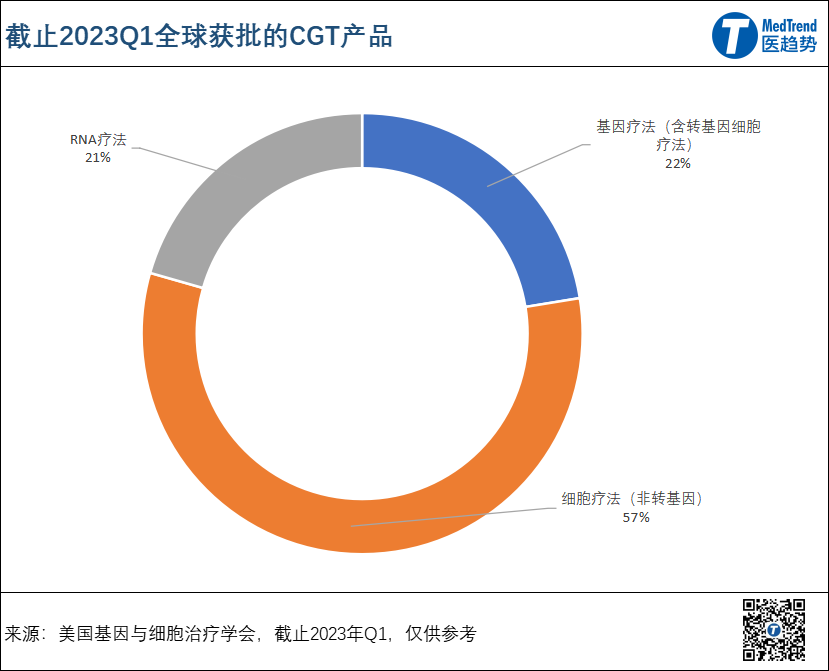
据报道,全球首款CGT疗法诞生于中国,是来自深圳赛百诺公司于2004年获批的产品Gendicine;截止2023年Q1,全球已有107款CGT疗法获批上市。
*** 包括:61款细胞疗法(非转基因)、24款基因疗法(含转基因细胞疗法,如CAR-T)、22款RNA疗法(包括mRNA疫苗)。
而CGT开始大规模被大众所熟知并热议,经历了两个时期:
时期一:2017年,全球第一款CAR-T产品获得美国FDA批准上市,血液肿瘤不再是绝症,成为可被治愈或长期可控的慢性疾病。
*** 2021年,中国首例CAR-T治疗的淋巴癌患者在上海瑞金医院出院,体内癌细胞完全清零。
时期二:2020年,mRNA新冠疫苗“横空出世”,辉瑞借此一举重回全球药企TOP1(2022年营收破千亿美元)。
伴随着这两大时期,全球药企都开始纷纷布局这些细分领域。截止2023年6月:
全球有8款自体CAR-T疗法上市(来自:诺华1款、吉利德2款、BMS 2款、传奇生物/强生1款、复星凯特1款、药明巨诺1款)。
全球有3款mRNA新冠疫苗上市(来自:辉瑞/BioNTech1款、Moderna1款、石药集团1款)。
然而,从2022下半年开始,由于CAR-Ts赛道拥挤以及同质化严重,mRNA在新冠领域的应用红利见底,头部药企们已经开始重新调整方向,包括:小核酸药物、mRNA疗法、mRNA+CAR-T/基因编辑、体内基因编辑、CAR-Ts自身免疫疾病治疗等。
▎GSK:进军小核酸药物
2023年4月,GSK宣布退出“转基因细胞疗法”(主要为CAR-T、TCR-T等)赛道。此后,有消息称GSK或看好寡核苷酸技术,打算进军小核酸药物领域(RNA疗法)。
小核酸药物是目前发展最成熟的CGT细分领域之一(属于RNA疗法),主要通过干扰或调节基因的表达来治疗疾病;包括寡核苷酸、小干扰RNA (siRNA)等。
其优点是具有高度的靶向性和特异性,可以用于抑制或调节特定基因的表达,从而干预疾病的发生和发展过程,尤其在癌症治疗、遗传性疾病治疗等方面。
目前全球已获批上市17款产品。
全球主要竞争者包括:Ionis、Alynlam、Sarepta等。
中国企业从2015年开始入局,且数量不多,主要包括圣诺制药、瑞博生物、腾盛博药等,处于临床早期。
▎Moderna:首个mRNA疗法用于罕见病
mRNA技术在新冠疫情告捷后,Nature预测将被更多应用于更多其他治疗及预防领域,尤其是肿瘤、罕见病。
全球主要布局企业包括:辉瑞/BioNTech、Moderna、CureVac等;
中国主要布局企业包括:艾博生物、嘉晨西海等;
2023年5月,美国基因细胞治疗学会(ASGCT)年会上,Moderna提交了在研mRNA疗法mRNA-3927用于罕见病丙酸血症(PA)I/II期临床研究中期数据。这也是mRNA疗法首次作为细胞内蛋白质替代疗法的临床试验结果公布。
▎辉瑞、Moderna、再生元:mRNA技术与CAR-Ts/基因编辑联合
mRNA技术拥有两个最为核心的部分:递送系统、编码mRNA本身;而“递送系统”正是CAR-Ts、基因编辑疗法的严重短板之一。因此,将mRNA技术与CAR-Ts/基因编辑联合或将有1+1>2的效果,尤其是体内基因编辑。
2022年,辉瑞与基因编辑头部企业Beam Therapeutics达成合作,利用其在mRNA/LNP方面的优势,共同推进肝脏、肌肉和中枢神经系统的罕见遗传疾病的体内碱基编辑疗法。
2023年2月,Moderna与Life Edit Therapeutics达成合作,开发体内mRNA基因编辑疗法。
2023年,再生元与基因编辑头部企业Intellia Therapeutics合作,其NTLA-2001使用LNP进行递送,实现转甲状腺素蛋白淀粉样变性(ATTR)治疗,目前已进入1期临床,是mRNA-LNP技术+基因编辑的范例。Intellia Therapeutics(市值40.57亿美元),2014年成立于美国,诺华是其投资者之一。
创始人是CRISPR-Cas9技术的另一发明者Jennifer Doudna。
6月14日,其“体内基因编辑”疗法针对遗传性血管性水肿(HAE)1期临床数据,显示使发作率降低95%。
▎礼来、诺华:布局体内基因编辑
礼来近来似乎大力加码体内体内基因编辑管线。
2023年5月,以总计超15亿美元,与基因编辑公司Scribe Therapeutics达成合作,共同开发针对特定神经和神经肌肉疾病的“体内基因编辑疗法”。
2023年6月,以总计超5亿美元,与Verve Therapeutics合作,重点推进Verve针对脂蛋白 (a)的临床前“体内基因编辑疗法”。Verve Therapeutics(市值11.2亿美元),2018年成立于美国。
拥有mRNA单碱基编辑技术,通过RNA进行基因组单个碱基水平上精确有效的编辑,不会在DNA中造成双链断裂。
2022年7月,其管线VERVE-101成为全球首个进入临床开发阶段的体内单碱基编辑疗法。
2022年6月,诺华与Precision BioSciences公司合作开发体内基因编辑疗法。
Precision Biosciences,2006年成立于美国,是ARCUS基因组编辑技术发明者。
利用这一专有技术,开发项目主要包括:用于治疗血红蛋白病的体内基因组编辑项目,用于治疗癌症的同种异体CAR-T项目。
有业内人士表示,想要实现基因编辑临床治疗的下一阶段转变,“新的递送技术”至关重要。
目前的递送手段,如脂质体纳米颗粒(LNP)、病毒类载体都不尽完美,在组织嗜性、免疫原性或长期效果等方面存在着不足。未来谁先突破这一技术或将成为该领域引领者。
▎诺华、AZ:加码CAR-Ts在自身免疫疾病领域
2023年5月底,诺华表示,未来其CAR-Ts管线针对自身免疫疾病的疗法将优先于肿瘤。
6月,阿斯利康宣布与Quell Therapeutics(一家专注于工程Treg细胞疗法的生物技术公司)达成协议,以开发多种CAR-Treg细胞疗法,或用于1型糖尿病 (T1D)和炎症性肠病(IBD)的治疗。
CAR-Treg(嵌合抗原受体调节性T细胞)和CAR-T(嵌合抗原受体T细胞)是两种不同类型的细胞治疗方法,它们在细胞来源、功能和应用领域上存在区别。
CAR-Treg细胞:研究主要集中在治疗自身免疫性疾病和移植排斥反应。通过引入CAR-Treg细胞,可以增强免疫调节功能,抑制异常免疫反应和炎症,改善自身免疫性疾病的症状和移植的结果。
而从“肿瘤治疗”转向“自身免疫疾病治疗”或将成为CAR-Ts新的“主流方向”。
03 中国市场:“自体CAR-T”仍是主流,最新技术尚处临床早期
在获批了全球第一款CGT产品后,中国企业似乎未能将这一“优势”继续壮大。目前全球已获批的107款CGT产品里,中国上市的仅占不到10%。
1、中国药监局最新监管文件仍“聚焦”自体CAR-T
当美国政府大力加码基因编辑时,中国药监局刚刚开始关注自体CAR-T。
6月26日,国家药监局药审中心发布了《关于公开征求〈自体CAR-T细胞治疗产品药学变更研究问题与解答(征求意见稿)〉意见的通知》。中国监管机构认识到了CGT产品的特殊性,并针对性的制定了多部政策或指导原则,以更好适应商业化需求。
从监管层面针对CGT疗法做调整固然很好,但似乎“没赶上”全球最新技术?
目前CAR-Ts赛道还有最大两个问题未得到根本解决,因此很难有重大突破:
1、适应人群很窄、不能治疗实体瘤(实体瘤临床研究大多停留在II期以前);
2、目前上市的都是自体CAR-T,无法规模量产(通用型CAR-T临床研究进展最快的仅到II期);
2、企业临床研发“扎推”CAR-Ts
作为CGT全球“第二大战场”,目前有80多个CGT国际临床研究中心在中国注册。但是CAR-Ts扎堆现象仍是最大问题。
中国CGT在研疗法约占全球约1/3(仅次于美国,排第二)。其中很大一部分仍在最拥挤的CAR-Ts赛道。
CAR-Ts赛道有超过500项临床研究来自中国企业(占比超55%)。
而在全球TOP药企已经“转向”的小核酸药物、mRNA疗法、mRNA+CAR-T/基因编辑、基因编辑领域,国内企业大多处于临床早期。
比如
小核酸药物:中国企业不多,主要为瑞博生物,腾盛博药、圣诺制药。
mRNA多元化疫苗:中国企业临床后期项目仍主要是新冠疫苗领域。其他都在临床早期,包括:斯微生物、嘉晨西海的mRNA肿瘤疫苗在临床I期。
mRNA疗法:中国企业进度处于前列的是嘉晨西海、嘉和生物与艾博生物。
mRNA与CAR-Ts/基因编辑联合:中国企业在这一领域布局的包括远泰生物、优卡迪、济因生物、先博生物等。
基因编辑:国内整体还尚处于临床早期及临床前阶段,但布局企业已超15家,其中进展最快的是博雅辑因。
可喜的是,中国科研积累正在加速相关产业进程。
截止2022年底,本土生物研究机构已经申请了3000多项与细胞和基因疗法相关专利。
中国头部创新药企也已布局CGT领域。
比如,百济神州与Shoreline等合作开发mRNA疗法和NK细胞疗法;君实生物自建小核酸药物研发平台、与嘉晨西海合作mRNA疗法;信达生物与驯鹿医疗合作开发CAR-T等。未来或许有更多与全球接轨的CGT技术布局。
此外,一个值得关注的风向是,2023年5月,Moderna在中国上海注册了一家名为美德纳(中国)生物科技有限公司的子公司,注册资本1亿美元。或将成为全球CGT头部企业在中国本土化布局的风向标。
延续了2022年的热度,2023Q1,在并不景气的市场上,CGT投资热度依然未减:CGT项目占比约19.3%(仅次于小分子、CXO),且单笔融资金额普遍超10亿元。
然而,无论是CAR-Ts,还是mRNA技术,中国企业布局方向似乎都慢一拍,需要更多有战略眼光的入局者。



评论