界面新闻记者 |
界面新闻编辑 | 谢欣
7月11日盘后,国内创新药龙头百济神州发布公告宣布,7月10日,公司全资间接子公司百济神州瑞士与诺华制药签署了《共同终止和释放协议》(下称“终止协议”)。终止协议自签署日起立即生效。生效后,百济神州瑞士重新获得开发、生产和商业化欧司珀利单抗的全部全球权利。
简而言之即是,诺华将欧司珀利单抗(ociperlimab)在相关国家和地区的独家许可权益退回给百济神州。这也是近期发生的第三起创新药企遭跨国药企“退货”的情况了,此前诺诚健华与加科思先后有核心产品遭到跨国药企合作伙伴“退货”。
此前,2021年12月,百济神州与诺华签订了《选择权、合作和许可协议》(下称“选择权协议”)。基于该选择权协议,诺华可以通过行使该选择权获得在美国、加拿大、墨西哥、欧盟成员国、英国等若干国家和地区对欧司珀利单抗进行开发、生产和商业化的独家许可。
为此,百济神州获得了3亿美元的首付款。如诺华在限定期限内行使选择权,百济还将获得最高约26亿美元的里程碑付款。这一交易金额一度刷新国内药企对外授权金额纪录。
此外,据双方协议,诺华同意启动并实施以欧司珀利单抗联合替雷利珠单抗(tislelizumab)治疗部分肿瘤的额外全球临床试验,并为此额外试验提供全部资金。另外,百济神州和诺华还保留将其专有产品与欧司珀利单抗进行联合商业化的全球性权利。

对于本次终止协议,百济神州对界面新闻回应称,是基于战略和财务考量。其不影响公司此前已收到的3亿美元首付款。公司临床研究团队期待继续推进欧司珀利单抗的开发项目,并将持续评估正在进行的用于治疗初治非小细胞肺癌(NSCLC)患者的Ⅲ期临床试验AdvanTIG-302的数据。同时,公司还将继续探索欧司珀利单抗与百济神州内部管线的联合用药前景。
不过,按照百济神州的说法,其大概率还会继续司珀利单抗联合替雷利珠单抗的联合用药临床试验,而诺华拥有替雷利珠单抗在海外的大部分权益,因此,也可以理解为,诺华虽然“退货”了,但实际上,也没全退。
欧司珀利单抗是一款TIGIT抑制剂,该靶点因在治疗肿瘤上的前景被广泛看好,因而有“下一个PD-1”之称。百济神州和诺华之所以在该药上有如此紧密的合作,是因为TIGIT抑制剂需要联用的特点和此前惊艳的临床数据。
在上一轮免疫治疗领域的竞争中,PD-(L)1抑制剂脱颖而出。不过,该药治疗患者的响应率仅有20%-30%,也就是说,起效的人群比例依然很小,因此,寻求联合用药成为药企们下一步的目标。TIGIT单药没有活性,但在与PD-(L)1的联用中表现出色。
在这一点上率先看到曙光的是跨国药企罗氏制药,早先,罗氏将其TIGIT单抗Tiragolumab(替瑞利尤单抗)联合PD-L1单抗Atezolizumab(阿替利珠单抗),用于一线治疗PD-L1阳性转移性非小细胞肺(NSCLC)。该疗法在Ⅱ期临床研究中表现出ORR(客观缓解率)的明显改善。为此,Tiragolumab还成为首个获美国食药监局(FDA)授予突破性疗法资格的抗TIGIT药物。
这结果使一批药企迅速跟上TIGIT抑制剂的研发。截至2021年6月末,除前述罗氏和百济外,默沙东、吉利德、百时美施贵宝、辉瑞等跨国药企纷纷入局,最快有产品进入临床Ⅲ期阶段。国内,君实生物、信达生物也有产品进入临床Ⅰ期。
此前,诺华自身在PD-(L)1竞赛中缺位,并获得了百济神州替雷利珠单抗在海外多国的权益,或因此在TIGIT单抗上继续与百济神州合作。
而TIGIT在百济神州自己的管线中也颇为重要。其被看作是继BTK抑制剂泽布替尼和PD-1替雷利珠单抗后的第三款重磅的自研产品。2021年12月,百济神州登陆科创板时在招股书中表示,公司的欧司珀利单抗是全球领先的3款TIGIT产品之一。且在临床前研究中,该产品比Tiragolumab对TIGIT的亲和力强大约4倍。彼时,百济对该产品临床阶段研发项目外部费用的总投资金额为17.4亿元,披露的TIGIT相关管线多达9条。
不过,从全球范围看,TIGIT抑制剂上的研发进展并不顺利。跑在最前面的罗氏首先连续遭遇两个滑铁卢。其前述联用组合用于治疗小细胞肺癌(SCLC)和一线NSCLC的Ⅲ期试验均未达到主要终点。
此外,百时美施贵宝、默沙东等跨国药企也相继传来失利消息。
今年,百时美施贵宝宣布决定终止其抗TIGIT药物BMS-986207的Ⅱ期临床试验,原因是出于安全考虑。3月,默沙东也公布,其PD-1+TIGIT复方制剂MK-7684A在治疗转移性NSCLC的Ⅱ期非注册KeyVibe-002研究中,未达到无进展生存期(PFS)的主要终点,且MK-7684A在数值上显示的疗效还不如老的化疗药物多西他赛。
不过,该领域在今年也有好消息。罗氏一线治疗晚期肝细胞癌患者的Ⅰb/Ⅱ期临床试验结果显示,Tiragolumab与一线肝癌疗法Tecentrig/Avastin联用,治疗组的ORR为42.5%,是对照组的近4倍。
据丁香园insight数据库,截至目前,全球TIGIT靶点上共有80条新药信息,尚未有产品获批上市。在国内,除百济神州外,最快处于临床Ⅲ期阶段的公司还有罗氏、默沙东、吉利德,最快处于临床Ⅰ/Ⅱ期的公司还有阿斯利康、康方生物、泽璟制药等。此外,君实、信达、恒瑞等公司的产品处于临床Ⅰ期阶段。
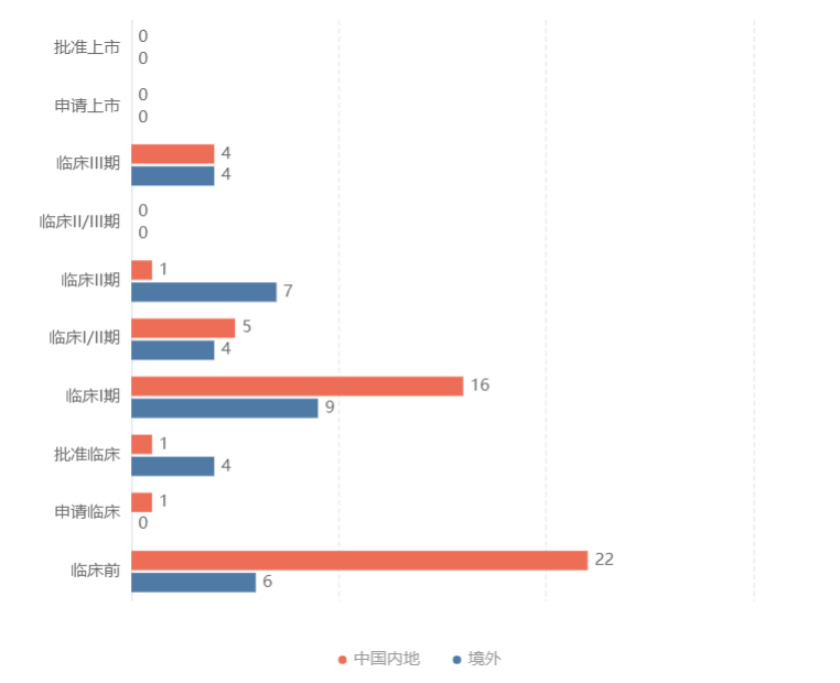
此外,君实生物的TIGIT产品此前也已完成海外授权。2022年1月,君实将该产品在美国和加拿大的独占许可授予Coherus。该交易是君实和Coherus签署的PD-1产品特瑞普利单抗海外授权协议的延伸。在TIGIT产品交易中,君实生物获得不可退回的3500万美元执行费,此外还包括累计不超过2.55亿美元的里程碑款,以及TIGIT产品在Coherus区域内年销售净额18%的销售分成。




评论